Estudio comparativo de medios de cultivo para crecimiento y recuperación del Streptococcus mutans ATCC 25175 “in vitro”
Rosalba Medina A. OD. MsC.1, Luis Carlos Moreno C. OD.1, María Constanza Velasco R. OD.1, Sonia Jakeline Gutiérrez C. Bsc.2
Grupo de Desarrollo Académico en Microbiología Oral, Facultades de Odontología y Medicina, Universidad Nacional de Colombia.
1Universidad Nacional de Colombia Facultad de Odontología -Sede Bogotá.
2Universidad Colegio Mayor de Cundinamarca - Programa de Bacteriología.
Correspondencia: revistanova@unicolmayor.edu.co
Recibido: 03-05-2005 / Aceptado: 03-06-2005
El presente estudio evaluó la recuperación in vitro de S. mutans ATCC 25175 en siete medios de cultivo: Mitis Salivarius Agar (MSA), Mitis Salivarius Agar-Bacitracina (MSB), Mitis Salivarius Agar- Kanamicina-Bacitracina (MSKB), Mitis Salivarius Agar-Bacitracina-Sulfisoxazol (MS-MUT), Tripticasa soya-Extracto de levadura-Sucrosa-Bacitracina Agar (TYS20B) (medios referenciados como selectivos), Agar Infusión Cerebro Corazón (BHI) (medio de enriquecido) y Agar Todd Hewitt (TH) (medio selectivo para Streptococcus). Se demostró una mayor recuperación del microorganismo en el medio TYS20B, seguido en orden decreciente de los medios: BHI, MSA, TH, MS-MUT, MSB y MSKB. El medio TYS20B, fue el más adecuado para el microorganismo; presentando un porcentaje de recuperación significativamente mayor a los demás medios selectivos evaluados, coincidiendo con el éxito obtenido en otros estudios para recuperación de S.mutans.
Palabras Claves: Streptococcus mutans, medios de cultivo, recuperación, Tripticasa soya-extracto de levadura-Sucrosa-Bacitracina Agar (TYS20B)
The present study evaluated the recovery in vitro of S. mutans ATCC 25175 in seven culture of media: Mitis Salivarius Agar (MSA), Mitis Salivarius Agar-Bacitracin (MSB), Mitis Salivarius Agar-Kanamycin- Bacitracin (MSKB), Mitis Salivarius Agar-Bacitracin-Sulfisoxazole (MS-MUT), Trypticase soy-Extract of yeast-Sucrose-Bacitracin Agar (TYS20B) (media indexed as selective), Infusion Brain Heart Agar (BHI) (enriched medium) y Todd Hewitt Agar (TH) (selective medium for Streptococcus). A bigger recovery of the microorganism was demonstrated in the medium TYS20B, continued in decrease order: BHI, MSA, TH, MS-MUT, MSB and MSKB. The medium TYS20B was the most appropriate for the microorganism; presenting a percentage of significantly more recovery to the other evaluated selective media, coinciding with the other studies in the world for recovery the S.mutans.
Keywords: Streptococcus mutans, culture media, recuperation, Trypticase soy-extract of Yeast-Sucrose- Bacitracin Agar (TYS20B).
La Caries dental es una enfermedad infecciosa de distribución universal, de naturaleza multifactorial, dinámica crónica transmisible; que ocurre en la estructura dentaria en contacto con los depósitos microbianos, debido al desequilibrio entre la sustancia dental y los productos metabólicos generados de la placa bacteriana, dando como resultado una pérdida de mineral de la superficie dental, cuyo resultado es la destrucción localizada de los tejidos duros (6).
Según Paul Keyes en 1960, quien en forma teórica y experimental estableció que la etiopatogenia de la caries obedece a la interacción simultánea de tres elementos o factores principales: un factor microorganismo. que en presencia de un factor sustrato. (ingesta de Carbohidratos), logra afectar a un factor .diente. (También denominado hospedero).
La interacción entre los tres elementos constituye, la base fundamental que dispara el mecanismo de acción determinante del desarrollo de la caries dental. Si estos confluyeran solo durante un periodo muy breve, la enfermedad cariosa no se produciría; por lo tanto, se ha agregado el tiempo de interacción de los mecanismos, así como diversas variables que modifican el proceso; como son los factores socioeconómicos y culturales que no solo condicionan hábitos dietéticos y de higiene oral sino que además modulan la respuesta inmune en el ámbito de la cavidad bucal a través de la saliva y el exudado gingival.
El S. mutans es el principal agente etiológico de la Caries Dental. En Colombia según el III Estudio Nacional de Salud Bucal (1), el 95% de la población mayor de 20 años tiene historia de caries, lo que convierte esta patología en un problema de salud pública. Para profundizar en el conocimiento del microorganismo y aportar a la solución de dicha situación es necesario contar con medios de cultivo que garanticen el crecimiento y la recuperación del patógeno causal (2-5).
El estudio de medios de cultivo para recuperación de S. mutans se viene dando mundialmente desde hace muchos años, mostrando resultados disímiles (13- 27,38). En Colombia la mayoría de los estudios no han utilizado medios de cultivo selectivos para este patógeno (7-12); en este contexto, el presente estudio evaluó la recuperación in vitro de S. mutans ATCC 25175 en siete medios de cultivo; con el fin de establecer el medio mas adecuado para la recuperación del microorganismo.
1. Cepa de referencia S. mutans ATCC 25175: para la recuperación de esta cepa se utilizó agar BHI (2-5,11), la cual fue posteriormente incubada a 37º C por 48 horas en condiciones de microaerofília, la pureza del cultivo se verificó mediante coloración de Gram, prueba de catálasa, hemólisis en agar sangre y pruebas bioquímicas, según protocolos estándar.
2. Medios de Cultivo: Teniendo en cuenta estudios internacionales (13-27), se seleccionaron siete medios según los siguientes criterios:
- MSA: uno de los primeros medios de cultivo desarrollado para la recuperación y aislamiento de S. mutans, obtenido comercialmente Difco®; base para la elaboración de MSB, MSKB y MSMUT; y utilizado en otros estudios (13,16,23,28).
- MSB: Medio de cultivo que se considera más selectivo que el MSA y que ha sido utilizado y comparado en un mayor número de estudios de recuperación y aislamiento de S. mutans (13,16,18-20,22-26,29-31)
- MSKB: modificación del MSB que presenta mayor selectividad; siendo ésta característica la más importante para el manejo de muestras clínicas (23,25), su poco uso hace necesaria su comparación.
- MS-MUT: medio de cultivo que se ha desarrollado para el aislamiento de S. mutans, es una modificación del MSB; presenta una mayor selectividad frente a S. sobrinus y no ha sido comparado en otros estudios fuera del citado (27).
- TYS20B: medio de cultivo que ha dado óptimos resultados tanto en recuperación como en selectividad en algunos estudios comparativos recientes (20,25), además es fácil de preparar y económico (20), aspectos de valiosa importancia en nuestro medio.
Y los medios de cultivo utilizados convencionalmente en el Laboratorio de Investigación del Grupo de Desarrollo Académico en Microbiología Oral-Facultades de Odontología y Medicina Universidad Nacional de Colombia:
TH Difco® y BHI Oxoid®. Durante la preparación de los medios de cultivo se utilizó una cámara extractora, con el objetivo de reducir el riesgo de contaminación de los mismos; cada medio de cultivo se preparó de acuerdo a las especificaciones del fabricante, controlando la calidad en la esterilización de los mismos (32).
3. Concentración microbiana y diluciones: se realizó una suspensión bacteriana a una absorbancia entre 0.08 y 0.1, a una longitud de onda de 625nm comparándola con la escala de turbidez de Mc Farland Nº 5 como patrón; esta suspensión es equivalente a 1X108 UFC/ml; luego se realizaron diluciones seriadas 1:10, de las cuales se tomaron 104, 105, 106.
4. Siembra y lectura en los medios de cultivo: a cada uno de los medios se le adicionó 0.25ml de la suspensión obtenida, técnica descrita por Westergren G, Krasse B. en 1978 (33); todos los medios de cultivo recibieron la misma concentración del inoculo 104, 105, 106; este proceso se realizó por triplicado. Para su incubación se utilizaron condiciones de microaerofília (18), a una temperatura de 37º C, con conteo a las 48 horas en todos los medios de cultivo. El Método de recuento escogido fue el de conteo de células viables, expresado en Unidades Formadoras de Colonia (UFC); para realizar el recuento se utilizó una cámara de Spencer.
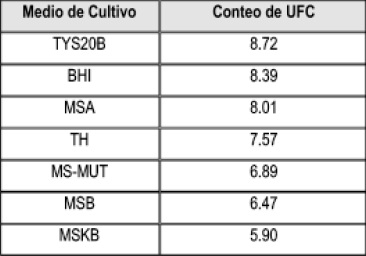
La mayor recuperación del S. mutans ATCC 25175 se observó en el medio de cultivo TYS20B con una diferencia significativamente mayor comparada con los demás medios evaluados; en orden decreciente: BHI, MSA, TH, MS-MUT, MSB, MSKB, Tabla 1 y Figura 1.
Tabla 1. Conteo de UFC en escala logarítmica.

Figura 1. Comportamiento de los medios de cultivo con respecto a los resultados de las UFC expresadas por medio de escala logarítmica.
El medio TYS20B mostró una mayor recuperación de S. mutans en comparación al medio BHI, que por su aporte de nutrientes es utilizado para el cultivo de una amplia variedad de microorganismos exigentes, tanto aerobios como anaerobios facultativos (34). Este último se viene utilizando en el Laboratorio de rutina para la reactivación y recuperación del S. mutans (2-5). La óptima recuperación que mostró el medio TYS20B se podría deber al aporte de nutrientes obtenidos del caldo tripticasa soya y del extracto de levadura, componentes utilizados para el crecimiento y recuperación de microorganismos exigentes (34), y del 20% de sucrosa. Es importante resaltar como ventaja la selectividad que tiene este medio comparado con BHI por la adición de bacitracina (20,35) y la presencia de sucrosa que interfiere con el crecimiento de otros microorganismos, sin embargo, esta última característica hace necesario tomar precauciones en el manejo de su concentración debido a que altas concentraciones de sucrosa interfieren con la glicólisis del S. mutans (36).
El medio de cultivo MSA ocupó el tercer lugar en recuperación, esto podría justificarse a que en su composición presenta Azul de tripan y Cristal violeta, los cuales inhiben otros microorganismos contaminantes a las concentraciones utilizadas, aunque se ha reportado que dichos componentes pueden afectar el crecimiento del S. mutans, particularmente del serotipo a (13-14). El medio TH que es un medio de cultivo empleado para la recuperación de Streptococcus B-hemolíticos (37) presentó un menor porcentaje de recuperación. Tabla 1, Figura 1.
En el medio MS-MUT se obtuvo una mejor recuperación de S. mutans que en el medio MSB del cual se derivó y del que se diferencia por presentar la adición sulfisoxazol y el aumento en la concentración de bacitracina, en este medio aunque se presentó una mayor concentración de antimicrobianos no se afectó el crecimiento del microorganismo; el tercer elemento que se modificó en el MS-MUT fue la sucrosa disminuyendo su concentración con respecto al MSB, la cual se ha reportado en la literatura científica que interfiere con el crecimiento de algunos microorganismos, incluyendo el mismo S. mutans (19,20,36).
El medio de cultivo MSB, presentó uno de los más bajos índices de recuperación del microorganismo. Como ya se mencionó, la concentración de sucrosa en este medio pudo haber afectado la recuperación del S. mutans (19,20,36).
EL medio de cultivo que presentó la menor recuperación del microorganismo fue el MSKB, medio modificado del MSB con adición de kanamicina y sorbitol al 7%, mostrando que a altas concentraciones de este reducen la recuperación de S. mutans (23). Un aspecto que se debe tener en cuenta al utilizar este medio es el pH, por que según Rogers AH (21), el sorbitol puede ser metabolizado a un pH de 7.0, pero no a pH de 5.5. Aunque la baja recuperación del microorganismo coincide con los resultados obtenidos por Wan AKL et al 2002 (25), se recomienda en futuras investigaciones relacionar este parámetro.
En el presente estudio, el medio de cultivo que present ó un mayor crecimiento in vitro del S. mutans ATCC 25175 fue el TYS20B, mostrándose como el medio adecuado para la recuperación del microorganismo.
Adicionalmente, presenta otras ventajas como son: fácil de elaborar y económico, este resultado coincide con el obtenido en otros estudios para recuperación de S. mutans (20,25). En el estudio de Hirasawa M, Takada K 2003 (27), se muestra que la adición de sulfisoxazol no interfiere en el crecimiento del S. mutans y contribuye con la selectividad de este con respecto a microorganismos como el S. sobrinus, colonizador de sitios ya cariados, detectado en muestras clínicas en el medio MSB(22), hallazgo que se correlaciona con el obtenido en el presente y otros estudios (21,25); en el cual la adición de sulfisoxazol y la reducción de sucrosa permitieron una mayor recuperación de S. mutans en MS-MUT con respecto al MSB. Se propone para futuros trabajos con muestras clínicas adicionar 0.02% sulfisoxazol al medio TYS20B.
Los medios de cultivo que presentaron bajas proporciones de crecimiento del microorganismo no se pueden descartar en futuros trabajos, debido a que en muestras clínicas pueden ser más selectivos que los medios que mostraron mayor recuperación in vitro.
Finalmente, es importante anotar que estudios realizados por diversas instituciones en Colombia que involucran aislamientos de S. mutans (7-12), en general, no utilizan medios de cultivo selectivos para este microorganismo, aumentado así el riesgo de contaminación por flora acompañante y por consiguiente generando posibles falsos positivos; haciéndose necesario crear un consenso para la recuperación de este importante patógeno causal en el estudio de la caries (enfermedad que presenta alta incidencia en el país, afectando la calidad de vida (1)).
1. Ministerio de Salud. Galviz RV. III Estudio Nacional de Salud Bucal - ENSAB III; II Estudio Nacional de Factores de Riesgo de Enfermedades Crónicas . ENFREC II; Tomo VII Estudio Nacional de Salud Bucal, Colombia 1999.
2. Guatibonza S. .Extracción del líquido de la cáscara de la nuez del marañón y determinación de la actividad antibacteriana en Streptococcus mutans. Trabajo de Pregrado Química- Facultad de Ciencias Universidad Nacional de Colombia Bogotá D.C.1999.
3. Gaitán SV, Rico Y, Medina R. .Estabilidad química y antibacteriana en Streptococcus mutans del líquido de la cáscara de la nuez del marañón (Anacardium occidentale) calentado a temperaturas de industrialización de la almendra .. Trabajo de Pregrado Química. Facultad de Ciencias Universidad Nacional de Colombia Distinción Meritoria, Bogotá D.C. 2000.
4. Pinto M, Rodríguez MC, Medina R. .Prueba .in vitro. Del líquido de la cáscara de la nuez del marañón (Anacardium occidentale) en el Streptococcus mutans.. Trabajo de Pregrado Facultad de Odontología Bogotá D.C. 1999; Distinción meritoria. Mención de honor XI Encuentro de Investigación en Odontología ACFO Medellín 2000.
5. Garzón F, Flomin B, Jiménez J, Medina R. .Efecto de la formación de sales de los componentes activos del líquido de la cáscara de la nuez del marañón (Anacardium occidentale) en la actividad antimicrobiana sobre el Streptococcus mutans.. Trabajo de Pregrado Facultad de Odontología Universidad Nacional de Colombia Bogotá D.C. 2002.
6. González MC y Col. Caries Dental. Guía de Práctica Clínica basadas en la evidencia, Proyecto ACFO.1998.
7. Martínez PM y Col. Capacidad del Streptococcus mutans para fermentar xilitol y sacarina sódica in vitro. Universitas Odontológica, Pontificia Universidad Javeriana Bogotá D.C. 2001.
8. Delgado y Col. Comparación del crecimiento in vitro de Streptococcus mutans y Lactobacillus acidophilus con edulcorantes. Universitas Odontológica, Pontificia Universidad Javeriana Bogotá D.C. 1999.
9. Gonzáles LP. Efecto del aspartame sobre el crecimiento del Streptococcus mutans a nivel experimental. Rev. del Centro de Estudios en Salud (CES) Medellín, 1996.
10. Peña. Adherencia de Streptococcus orales comparando diferentes rugosidades superficiales de la porcelana. Rev. CES Medellín, 1995.
11. Enrique F y Col. Efecto de la formación de sales de los componentes activos del líquido de la cáscara de la nuez del marañón (Anacardium occidentale) en la actividad antimicrobiana sobre el S. mutans. Tesis, Facultad de Odontología Universidad Nacional de Colombia, Bogotá D.C. 2001.
12. Morales E. Acción del Streptococcus mutans sobre el dextran exógenos. Tesis, Facultad de Odontología Universidad Nacional de Colombia Bogotá D.C. 1982.
13. Little WA et al. Comparative recovery of Streptococcus mutans on ten isolation media. J. Clin. Microbiol. 1977; 5(6):578-583.
14. Linke B, Harald A. New Medium for the Isolation of Streptococcus mutans and its differentiation from other oral Streptococci. J. Clin. Microbiol. 1977; 5(6):604-609.
15. Matsukubo T et al. A practical method for differentiating the salivary levels of Streptococcus mutans using a stabilized selective broth. Bull. Tokyo Dent. Coll. 1983; 24(4):195- 202.
16. Arneberg P et al. Selection of Streptococcus mutans and Lactobacilli in an intra-oral human caries model. J. Dent. Res. 1984; 63(10):1197-1200.
17. Ohta K et al. A study of a stabilized selective broth method for assessing Streptococcus mutans levels. Bull. Tokyo Dent. Coll. 1984; 25(2):53-56.
18. Tanzer JM et al. Glucose-Sucrose-Potassium Tellurite- Bacitracin Agar, an Alternative to Mitis Salivarius-Bacitracin Agar for Enumeration of Streptococcus mutans. J. Clin. Microbiol. 1984; 20(4):653-659.
19. Wade WG et al. An improved medium for isolation of Streptococcus mutans. J. Med. Microbiol. 1986; 22:319- 323.
20. Schaeken MJ et al. Comparative recovery of Streptococcus mutans on five isolation media, including a new simple selective medium. J. Dent. Res. 1986; 65(6):906-908.
21. Rogers AH. The effects of sorbate on oral Streptococci grown in continuous culture. J. Dent. Res.1986; 65(6):895-898.
22. Svanberg M, Krasse B. Comparative recovery of mutans Streptococci on two selective media. Caries Res. 1990; 24:36-38.
23. Kimmel L et al. A modified Mitis Salivarius Medium for a diagnostic test. Oral Microbiol. Inmunol. 1991; 6:275-279.
24. Dasanayake AP et al. Differences in the detection and enumeration of mutans Streptococci due in differences in methods. Arch. Oral Biol. 1995; 40(4):345-351.
25. Wan AKL et al. Comparison of five selective media for growth and enumeration of streptococcus mutans. Australian Dent. J. 2002; 47(1):21-26.
26. Beigthon D. A simplified procedure for estimating the level of Streptococcus mutans in the mouth. Br. Dent. J. 1986; 160:329-330.
27. Hirasawa M, Takada K. A new selective medium for Streptococcus mutans and the distribution of S. mutans and S. sobrinus and their serotypes in dental plaque. Caries Res. 2003; 37(3):212-217.
28. Lager A et al. Cultivatable bacteria in dentine alter caries excavation using rose-bur or Carisolv. Caries Res. 2003; 37:206-211.
29. Pieniäkkinen K. Comparison of the efficacy of 40% chlorhexidine varnish and 1% chlorhexidine-fluoride gel in decreasing the level of salivary mutans Streptococci. Caries Res. 1995; 29:62-67.
30. Wennerholm K, Emilson C. Sucrose retention and colonization by mutans Streptococci at different sites of the dentition. Caries Res. 1995; 29:396-401.
31. Chestnutt et al. Evaluation of the In vitro cariogenic potential of Streptococcus mutans strains isolated from 12-year-old children with differing caries experience. Caries Res. 1995; 29:455-460.
32. Finegold S, Martín WJ. Diagnóstico Microbiológico de Bailey-Scott. 6ª edición: Editorial Médica Panamericana 1983. 670p.
33. Westergren G, Krasse B. Evaluation of a micromethod for determination of Streptococcus mutans and Lactobacillus infection. J. Clin. Microbiol. 1978; 7(1):82-83.
34. Vandevenne CA, Ribes ME. Métodos de análisis microbiológicos de los alimentos. Editorial Díaz de Santos 2002. 248p.
35. Isaza C y Col. Fundamentos de farmacología en terapéutica. 2ª edición: Editorial Guillermo Lagos R. 1992. p. 503.
36. Iwami Y. Effect of sucrose monolaurate on acid production, levels of glicolytic intermediates, and enzyme activities of Streptococcus mutans. J. Dent. Res. 1995; 74(9):1613-1617.
37. Facklam RR. Manual de procedimientos para el aislamiento e identificación de Streptococcus. Organización Panamericana de la Salud. 1980.
38. Hirasawa M, Takada K. A novel selective medium for isolation of Streptococcus mutans. J. Microbiol. Methods 2005; 60: 189-193.