Producción de Astaxantina en Haematococcus pluvialis bajo diferentes condiciones de estrés
Judith Elena Camacho Kurmen1, Gloria González2 , Bernadette Klotz2
1Docente Investigadora del Programa de Bacteriología y Laboratorio Clínico de la Universidad Colegio Mayor de Cundinamarca Bogotá-Colombia. Doctorado en Biociencias, Universidad de la Sabana, Bogotá, Colombia
2Doctorado en Biociencias, Universidad de la Sabana, Bogotá, Colombia
Correspondencia: jelenacamacho@hotmail.com
Recibido: 15/02/2013 Aceptado: 23/05/2013
Las microalgas son fuente de un gran número de compuestos bioactivos de interés industrial, como los carotenoides que se utilizan como colorantes naturales en alimentación animal y humana, así como en la industria farmacéutica, cosmética y en la acuicultura. Además se han propuesto como agentes efectivos en la prevención de una variedad de enfermedades, debido a su capacidad antioxidante, inmunoregulaora, anti-inflamatoria y anti-cancerígena. El ketocarotenoide astaxantina es el más importante desde el punto de vista biotecnológico.
Hoy la mayor cantidad de astaxantina es producida por síntesis química y es vendida a un precio de US $2500/kg. El alto precio y el incremento en la demanda para este compuesto, especialmente de origen natural, en las diferentes industrias, hace que sea de interés la producción astaxantina a partir de microalgas como el Haematococcus pluvialis, que acumula cantidades importantes (más del 4%/g de peso seco) y de mejor calidad que las obtenidas por otras fuentes como levaduras y plantas.
La acumulación del pigmento en H. pluvialis ocurre durante la transformación de la microalga desde el estado vegetativo (fase verde) a aplanospora (fase roja) cuando cesa su crecimiento en la fase estacionaria. Los tipos de estrés que inducen a la acumulación de astaxantina son temperatura, intensidad lumínica, ciclos de luz/oscuridad, concentración de nutrientes, pH, especies reactivas de oxígeno, sales y presencia de inhibidores de procesos metabólicos a diferente nivel.
Es importante resaltar que esta microalga es de difícil cultivo; así como en la obtención del pigmento en cantidades de interés, debido a su ciclo celular complejo. De igual forma, un mayor entendimiento de las bases moleculares de la relación -condiciones de estrés-inducción- acumulación de astaxantina en H. pluvialis, podría ser útil para aumentar la productividad de astaxantina.
Palabras clave: carotenoides, Haematococcus pluvialis, microalga, astaxantina, condiciones de estrés.
Microalgae are a source of a large number of bioactive compounds of industrial importance, such as carotenoids used as natural colorants in food and feed, as well as in pharmaceuticals, cosmetics and aquaculture. They also have been studied as effective compounds for the prevention of different diseases due to their antioxidant, immunoregulatory, anti-inflammatory and anticarcinogenic properties.
In biotechnology applications astaxanthin is the most important ketocarotenoide. Currently most astaxanthin is produced by chemical synthesis and sold at U.S. $ 2500/kg. The high price and increasing demand of this compound in different industries, especially of natural origin creates an interest in the astaxanthin production from microalgae as Haematococcus pluvialis that accumulate significant amounts (more than 4%/g dry weight) and better quality what is obtained from sources such as yeast and plants.
The pigment accumulation in H. pluvialis occurs during the transformation of microalgae from the vegetative state (green phase) to aplanospora (red phase) when growth ends in the stationary phase. The types of stress that induce astaxanthin accumulation are temperature, light intensity, cycles of light / dark, nutrient concentration, pH, reactive oxygen species, salts and presence of metabolic processes inhibitors at different levels.
Is important to take in account that this microalgae is hard to grow and obtain the pigment in amounts of interest could be complicated due to complex cell cycle. Similarly, a better understanding of the molecular basis of the relationship, stress-inducing conditions, astaxanthin accumulation in H. pluvialis, might be helpful for increasing productivity of astaxanthin.
Key words: carotenoid, Haematococcus pluvialis, microalgae, astaxantina, stress-conditions.
Los carotenoides son un grupo de pigmentos encontrados en la naturaleza en plantas, y a nivel microbiano. Tienen un rol funcional en el desarrollo, fotosíntesis y estabilidad de la membrana, dando protección al daño fotodinámico (1-4). Se han caracterizado al menos 700 carotenoides, son precursores de fitohormonas y proveen adaptación ambiental (5,6).
Los carotenoides ejercen una función protectora por su alto poder antioxidante y también son importantes ingredientes de la dieta humana. Algunos estudios sugieren que previenen algunas enfermedades crónicas y ciertos cánceres (6).
Por otra parte, se ha analizado la ruta biosintética de carotenoides, conociéndose dos rutas (5). Además se han identificado 25 genes carotenogénicos, que producen diferentes funciones catalíticas en las síntesis de carotenos (7) y algunos de estos genes han sido clonados y expresados funcionalmente en E. coli. (4,8,9) Estos son componentes esenciales de todas las células eucariotas fotosintéticas (10).
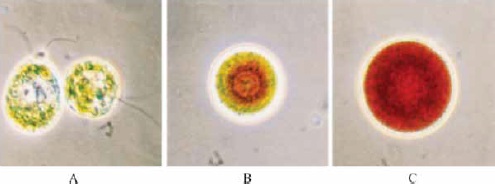
El alga unicelular H. pluvialis es una de las mejores fuentes de carotenoides secundarios rojos como la astaxantina, Figura 1, en especial para producirla biotecnológicamente. La astaxantina tiene uso farmacéutico, cosmético y como aditivo de pigmentación en la acuacultura (salmón) (1,11-13) y para yemas de huevo (14,15).

Figura 1. Secuencia de desarrollo de las células de H. pluvialis.(A) Célula verde (B) Célula con acumulación de carotenóides extraplastidicos e incremento de tamaño (C) Aumento de tamaño con quistes-rojos. Fuente: Proc. Natl. Acad. Sci. USA. Plant Biology.1998; 95:11482-11488(16)
Recientemente ha llamado la atención como un suplemento nutricional, siendo inhibidor de la peroxidación de lípidos, reductor de la inflamación gástrica. Adicionalmente, disminuye el riesgo de arteriosclerosis y previene la carcinogénesis (14), además tiene potencial neuroprotector e inmunomodulador (11) y sirve como alimento nutracéutico por su alto poder antioxidante (8,12,17,18).
La demanda mundial para β-caroteno de origen natural está alrededor del 15 a 20%, una similar demanda para astaxantina de origen natural está emergiendo en el mercado nutracéutico que mueve billones de dólares. Además la producción biotecnológica a partir de H. pluvialis, es ventajosa sobre la síntesis química y la extracción a partir de crustáceos (19).
Química de la astaxantina
La molécula de astaxantina tiene dos carbonos asimétricos localizados en las posiciones 3 y 3’ sobre los dos anillos bencénicos al final de la molécula. Diferentes enantiomeros de la molécula son resultantes de la unión de los grupos hidroxilo a los átomos de carbono, que son centros de asimetría. Figura 2.
Cuando los grupos hidroxilo se unen sobre el plano de la molécula se dice que están en la configuración R y cuando los grupos hidroxilo se unen bajo el plano de la molécula se dice que están en la configuración S. Así, los tres posibles enantiómeros son designados R,R’; S,S’ y R,S’(meso). El Haematococcus primeramente contiene monoesteres de astaxantina (20).
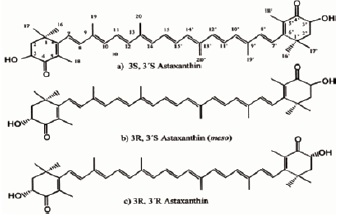
Figura 2. Isómeros configuracionales de astaxantina
La composición de los esteres de astaxantina en Haematococcus es similar a la de los crustáceos, fuente de dieta natural de los salmones. Siendo el contenido de astaxantina en quistes de Haematococcus; aproximadamente de 70% monoesteres, 25% diesteres y 5% libre. El alga Haematococcus provee la configuración 3S,3’S de astaxantina, mientras la levadura Phaffia contiene 3R, 3’R astaxantina pura, y la astaxantina sintética es una mezcla de los tres isómeros (20).
Condiciones de estrés ambiental en cultivos de H. pluvialis
Fisiológicamente la acumulación de astaxantina en H. pluvialis ocurre en respuesta a varias condiciones de estrés ambiental como; alta intensidad de luz, limitaciones de nitrógeno, fósforo y estrés por sal (14,21,22).
El cambio morfológico en H. pluvialis de células vegetativas verdes, para incrementar el número de células, a células con quistes rojos que acumulan astaxantina es inducido por algunos factores, tales como; temperatura alta, deficiencia de nutrientes (nitrato, magnesio, sulfato y fosfato), alta intensidad de luz, alta salinidad y estrés oxidativo (12,17,23,24). Sus quistes maduros son a menudo responsables del color rojo sanguíneo visto en el fondo seco de rocas afuera de charcos y de baños de aves. Este color es causado por astaxantina la cual se cree protege los quistes maduros del detrimento de los efectos de los rayos UV, cuando están expuestos a los rayos solares directos (25).
En el ciclo de vida del H. pluvialis se ha observado que las células verdes vegetativas con dos flagelos crecen autotróficamente en la luz y heterotróficamente en la oscuridad (26). El H. pluvialis es una microalga que puede crecer bajo condiciones fotoautotróficas, heterotróficas y mixotróficas (27).
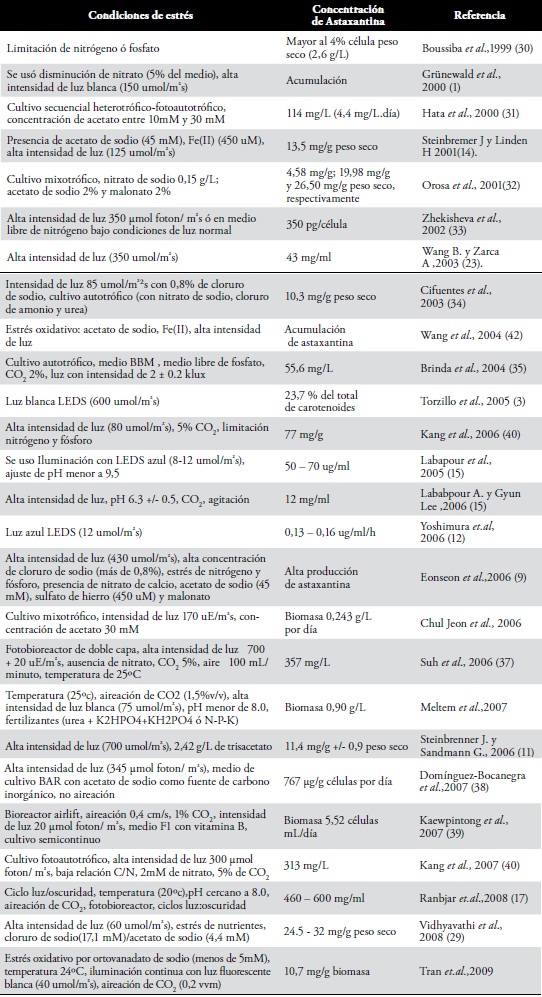
Otras de las condiciones de estrés ensayadas son: estrés de nutrientes, alta intensidad de luz, alta salinidad (7,28), pH y nutrientes orgánicos como acetato (9) ó combinación cloruro de sodio/acetato de sodio, aumentando el contenido total de carotenoides y contenido total de astaxantina (29). En la Tabla 1 se pueden observar en forma general las diferentes condiciones de estrés ensayadas en los estudios revisados (1-51), incluyendo el uso de fotobioreactores, mezclándolo con ciclos irregulares de luz/oscuridad (17).
Tabla 1. Condiciones de estrés en cultivos de H. pluvialis relacionadas con concentración de astaxantina.
Ruta de biosíntesis de Astaxantina en H. pluvialis
En la biosíntesis de carotenoides el primer paso es la condensación del geranil-geranil difosfato (GGPP) a fitoeno, modificado por la enzima fitoeno sintasa (PSY), como se observa en la Figura 3.
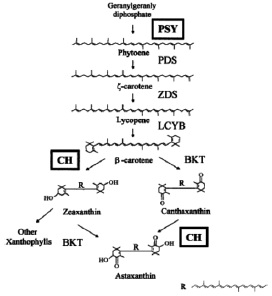
Figura 3. Ruta de biosíntesis del carotenoide astaxantina en H. pluvialis (14)
Fuente: Steinbremer J.;Linden H. Regulation of two carotenoid byosinthesis genes coding for phytoene synthase and carotenoid hydroxylase during stress-induced astaxanthin formation in the green alga. Haematococcus pluvialis. Plant Physiology. 2001;125:810 - 817.
Los siguientes pasos son llevados fuera de la membrana localizando enzimas como; fitoeno
desaturasa (PDS) y licopeno β-cyclasa (LCY). Según estudios realizados la fitoeno desaturasa
es regulada por los niveles del mRNA y se ha establecido que los carotenoides secundarios se
acumulan fuera del cloroplasto, siendo transportados del sitio de biosíntesis (cloroplasto) al sitio de acumulación (vesículas localizadas en el citoplasma) (1,9).
Las rutas metabólicas secundarias sirven para explorar nuevas estructuras químicas a mínimos costos, en especial a través de la identificación de enzimas que pueden actuar sobre diversos sustratos (5). Todas las enzimas de la ruta son reguladas por genes y son sintetizadas en el citoplasma de las células como precursores polipéptidicos (3).
La ingeniería genética es una opción para mejorar la ruta biosintética de los carotenoides para producir astaxantina (8) en H. pluvialis (9), modificando el gen de la fitoeno desaturasa (PDS) (11) o usando los genes carotenogénicos en Saccharomyces cerevisiae (19) como fitoeno desaturasa (crtl) y la bifuncional fitoeno sintasa/licopeno ciclasa (crtYB) (41).
En la fitoeno desaturasa (PDS) se ha estudiado también la duplicación de genes a PDS1 y PDS2, (10), lo cual no ha sido reportado en H. pluvialis. La biosíntesis de astaxantina en Haematococcus sigue la ruta general de carotenos hacia la formación del β-caroteno.
En estudios realizados in vitro e in vivo utilizando diferentes inhibidores en el análisis de la producción de astaxantina en H. pluvialis han encontrado otras enzimas β-caroteno ketolasa (BKT), β-caroteno oxigenasa (CRTO) y β-caroteno hidroxilasa (CHY o CRTR-B), Figura 4. El BKT convierte el β-caroteno a cantaxantina vía equinenona, siendo regulado por el CHY resultando en la formación de astaxantina. Los genes para ς-caroteno desaturasa (ZDS) y carotenoide isomerasa (CRTISO) no han sido reportados en Haematococcus (9,29).
Se han observado actividades biofuncionales para la actividad separada de β-caroteno hydroxylasa y ketolasa regulada por dos genes separados, uno de los cuales (crtS) se ha clonado en otros organismos (19). Además se sugiere que se puede involucrar otra enzima en el proceso de síntesis de astaxantina, por ser este un carotenoide, como la plastido terminal oxidasa (PTOX); la cual se ha expresado bajo condiciones de estrés para mejorar la producción de carotenoides (42). Aunque los pasos específicos de biosíntesis de astaxantina son llevados afuera del citoplasma, las enzimas de la ruta carotenoide parecen estar localizadas en los cloroplastos (9,29).
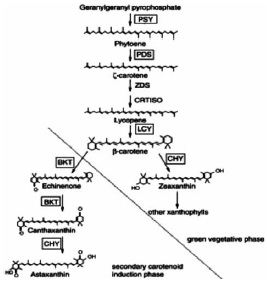
Figura 4. Ruta de síntesis de carotenoides secundarios en H.pluvialis (29)
Fuente: Vidhyavathi Raman, Venkatachalam L., et al. Regulation of carotenoid byosinthetic genes expression and carotenoid accumulation in the green alga Haematococcus pluvialis under nutrient stress conditions. Journal of Experimental Botany. 2008;59(6):1409-1418
A pesar de que algunos genes reguladores para enzimas de la ruta biosintética de carotenoides han sido identificados en varias especies, incluyendo algas, aún no se conoce bien la regulación de la carotenogénesis in vivo (9).
Correlación condiciones de estrés - expresión genética en cultivos de H. pluvialis durante la producción de astaxantina
La dilucidación de las rutas sintéticas de carotenoides y el enorme progreso en la clonación de genes; estableciendo los genes, las enzimas implicadas y conociendo como es el proceso y su regulación (1), han aportado las herramientas necesarias para realizar ingeniería genética y así incrementar la síntesis de carotenoides mediante el aumento a la tolerancia a condiciones de estrés (5,14,15). La mayoría de manipulaciones va dirigida a aumentar el contenido de licopeno y β-caroteno, aprovechando la sobreexpresión de la fitoeno desaturasa (PDS) (1) y fitoeno sintasa (PSY) (14). Además se evidencia la existencia de una sobrerregulación de un múltiple mecanismo de defensa antioxidante, espacialmente y temporalmente, para proteger las células del H. pluvialis en contra del estrés oxidativo (24).
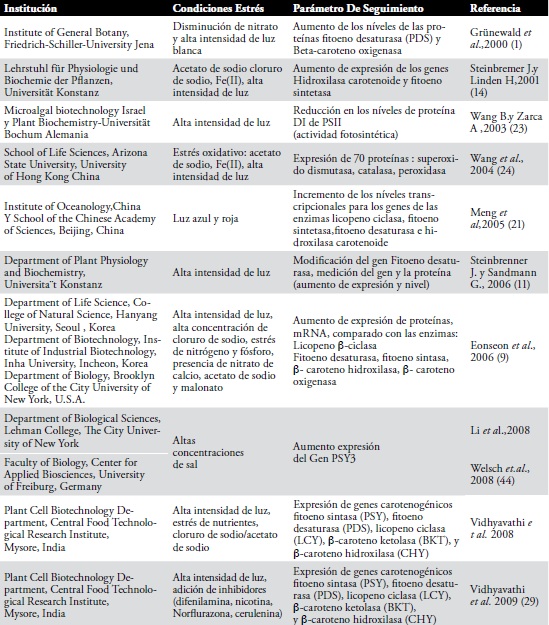
La expresión de genes carotenogénicos, fitoeno sintasa (PSY), fitoeno desaturasa (PDS), licopeno ciclasa (LCY), β-caroteno Ketolasa (BKT) y β-caroteno hydroxilasa (CHY), se aumenta bajo las condiciones de estrés de nutrientes, alta intensidad de luz en combinación con cloruro de sodio/ acetato de sodio (29). El estrés de nutrientes y la alta intensidad de luz inducen la expresión de los genes biosintéticos de astaxantina, BKT y CHY, transitoriamente. El aumento de la expresión de estos genes se observó con acetato de sodio y cloruro de sodio/acetato de sodio, mientras la expresión fue demorada con cloruro de sodio (29).
Diferentes expresiones de genes carotenoides durante la carotenogénesis indican su probable regulación en los diferentes estados de acumulación del carotenoide. En un estudio realizado en el 2001, se reportó un alto nivel de expresión para genes PSY y CHY, cuando las células estuvieron expuestas a alta intensidad de luz y cloruro de sodio (14,29). En la familia de genes PSY se han identificado los genes PSY1,PSY2 y PSY3, en condiciones de estrés ambiental; como sequía y presencia de sal, estableciendo que el gen PSY3 es importante en el flujo de la regulación de carotenoides en respuesta a condiciones de estrés (43,44) lo cual no ha sido reportado en H. pluvialis.
El primer estudio que presenta la regulación de carotenogénesis general y específica para astaxantina bajo la influencia de nutrientes y otras condiciones de estrés, se realizó en el 2008, analizando el nivel de expresión y de metabolismo usando inhibidores transcripcionales y transduccionales (29).
En la Tabla 2 se presenta una relación de algunos estudios que nos permite correlacionar condiciones de estrés- expresión genética, teniendo en cuenta las determinaciones realizadas y las instituciones involucradas (grupos de investigación).
Tabla 2. Correlación condiciones de estrés-expresión genética en cultivos de H. pluvialis durante la producción de Astaxantina
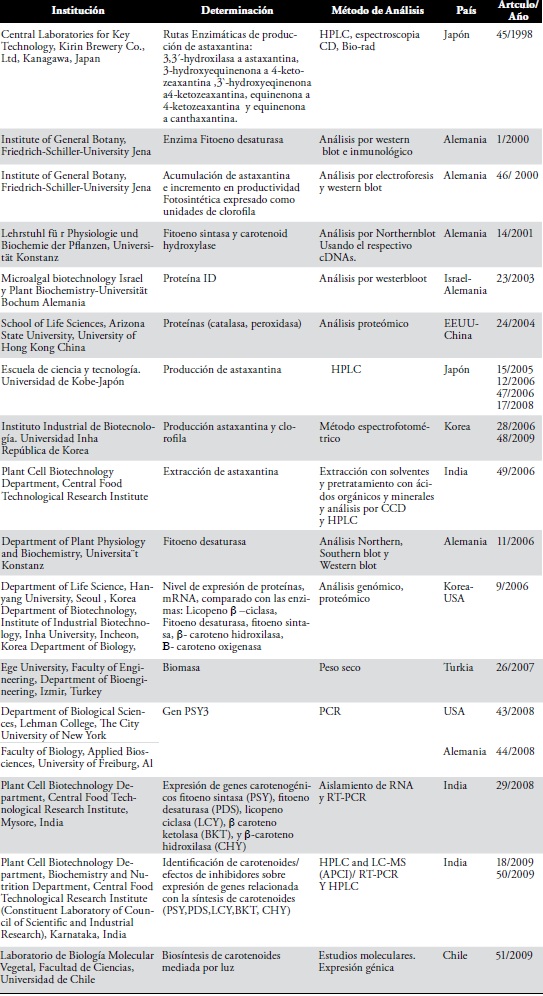
En la Tabla 3 se presenta la relación de las diferentes instituciones y grupos de investigación que se encuentran trabajando en esta temática, identificando los diferentes métodos de análisis propuestos por cada una, correlacionándola con la determinación realizada, el país y el año de publicación.
Tabla 3. Relación de las diferentes instituciones y grupos de investigación en Haematococcus pluvialis
Aunque existen un gran número de estudios de la influencia de diferentes condiciones de estrés sobre la expresión de genes carotenogénicos en H. pluvialis, se estableció que estudios sobre la influencia de otros factores de estrés o de todos aplicados en forma simultánea son muy limitados, así como estudios que relacionen estas condiciones con la expresión de genes carotenogénicos durante la producción de astaxantina.
Los estudios usando varios inhibidores indican que la carotenogenesis en general y la inducción de carotenoides secundarios está regulada a nivel transcripcional y transduccional, y se constituye en un tema de interés a investigar para entender los genes involucrados, las proteínas y la actividad enzimática durante la inducción de acumulación de carotenoides secundarios, en especial astaxantina.
Respecto a los grupos que trabajan esta temática, vemos que es un tema de interés en varias instituciones alrededor del mundo en países como; Alemania, Estados Unidos, Japón, India, Corea, China, Turquía, involucrando no solo el estudio de la correlación condiciones de estrés, expresión genética, producción de astaxantina, sino también el uso de diferentes métodos de análisis y la ingeniería genética, ya sea en el mismo H. pluvialis u otros microorganismos como E. coli o S. cerevisiae; siempre en la búsqueda de conocer mejor la ruta biosintética, las proteínas involucradas, las enzimas y los genes expresados para mejorar la producción de astaxantina.
1. Grünewald K, Manfred E, Hirschberg J, Hage C. Phytoene desaturase is localized exclusively in the Chloroplast and up-regulated and the mRNA level during accumulation of secondary carotenoids in Haematococcus pluviali (Volvocales,Chlorophyciae). Plant Physiology.2000;122:1261-1268.
2. Lohr M, Chung-Soon, Grossman A. Genome-Based Examination of Chlorophyll and Carotenoid Biosynthesis in Chlamydomonas reinhardtii. Plant Physiology.2005; 138: 490-515.
3. Torzillo G, Tolga G, Oya I, Gökpinar T. Photon irradiance required to support optimal growth and interrelations between irradiance and pigment composition in the green alga Haematococcus pluvialis. Eur. J. Phycol. 2005; 40: 233-240.
4. Bosung K, Jae-Cheol J, Benjamin N, Schmidt-Dannert C, Dordick J. Preparation, Characterization, and Optimization of an In vitro C30 Carotenoid Pathway. Applied and environmental microbiology. 2005;71: 6578-6583.
5. Umeno K, Arnold F. A C35 Carotenoid Biosynthetic Pathway. Applied and Environmental Microbiology. 2003; 69: 3573-3579.
6. Römer S, Fraser P. Recent advances in carotenoid biosynthesis, regulation and manipulation. Planta. 2005; 221: 305-308.
7. Yasuhiro N, Kyoko A, Hiroaki K, Yoshikazu S, Kazutoshi S, Akiyoshi S, Sadao K, Wataru M, Norihiko M. Elucidation of a Carotenoid Biosynthesis Gene Cluster Encoding a Novel Enzyme, 2,2-Hydroxylase, from Brevundimonas sp.Strain SD212 and Combinatorial Biosynthesis of New or Rare Xanthophylls. Applied and Environmental Microbiology. 2005;71:4286-4296.
8. Rick W. Ye, Kristen J. Stead, Henry Yao, and Hongxian He. Mutational and Functional Analysis of the B-Carotene Ketolase Involved in the Production of Canthaxanthin and Astaxanthin. Applied and Environmental Microbiology, 2006; 72: 5829-5837.
9. Eonseon J, Lee Ch, Polle J. Secondary Carotenoid Accumulation in Haematococcus (Chlorophyceae): Biosynthesis, Regulation, and Biotechnology. J. Microbiol. Biotechnol. 2006; 16: 821-83.
10. Frommolt R, Werner S, Paulsen H, Goss R, Wilhelm C, Zauner S, Maier U, Grossman A, Bhattacharya D, Lohr M. Ancient Recruitment by Chromists of Green Algal Genes Encoding Enzymes for Carotenoid Biosynthesis. Mol. Biol. Evol. 2008; 25: 2653-2667.
11. Steinbrenner J, Sandmann G.. Transformation of the Green Alga Haematococcus pluvialis with a Phytoene Desaturase for Accelerated Astaxanthin Biosynthesis. Applied and Environmental Microbiology. 2006; 72: 7477-7484.
12. Yoshimura S, Ranbjar R, Inoue R, Katsuda T, Katoh S. Effective utilization of transmitted light for Astaxanthin production of Haematococcus pluvialis. Journal of Bioscience and Bioengineering. 2006; 102: 97-101.
13. Damiani M, Leonardi P, Pieroni O, Caceres E. 2006.Ultrastucture of the cyst wall of Haemotococcus pluvialis (Chlorophyceae): wall development and behaviour during cyst germination. Phycologia .2006; 45: 616-623.
14. Steinbremer J, Linden H, Regulation of two carotenoid byosinthesis genes coding for phytoene synthase and carotenoid hidroxylase during stress-induced astaxanthin formation in the green alga. Haematococcus pluvialis. Plant Physiology. 2001;125: 810 - 817.
15. Labapour A, Shimahara K. Hada K, Kioui Y, Katsuda T, Katoh S. Fed-batch culture under illumination with blue light emitting diodes (LEDS) for Astaxanthin production by Haematococcus pluvialis. Journal of Bioscience and Bioengineering. 2005; 100: 339-342.
16. Sun Z, Cunninghan F, Ganti E. Differential expression of two isopentenyl pyrophosphate isomerases and enhanced carotenoid accumulation in a unicellular chlorophyte. Plant biology. 1998; 95:11482-11488.
17. Ranbjar R, Inoue R, Katsuda T, Yamaji H. Katoh S. High efficiency production of Astaxanthin in an airlift hotobioreactor. Journal of Bioscience and Bioengineering. 2008;106:204-207.
18. Ranga R, Sarada A, Baskaran V, Ravishankar G. Identification of Carotenoids from Green Alga Haematococcus pluvialis by HPLC and LC-MS (APCI) and Their Antioxidant Properties. J. Microbiol. Biotechnol. 2009;19:1333-1341.
19. Martín J, Gudiña E, Barredo J. Conversion of β-carotene into astaxanthin: Two separate enzymes or a bifunctional hydroxylase-ketolase protein? Microbial Cell Factories. 2008; 7(3).
20. Amos R. Handboook of Microalga. Culture Biotechnology and applied Phycology. Blackwell publishing. India. 2005.
21. Meng Ch, Teng Ch, Jiang P, Qin P, Tseng Ch. Cloning and Characterization of β-Carotene Ketolase Gene Promoter in Haematococcus pluvialis. Acta Biochimica et Biophysica Sinica. 2005; 37: 270-275.
22. Hu H, Wei Y. 2006. The freshwater algae of China. Systematics, taxonomy and ecology. [4 pls of 16 figs], [i-iv], i-xv, 1-1023 pp. China: www.sciencep.com
23. Wang B. Zarca A. Astaxanthin accumulation in Haematococcus pluvialis (Chlorophyciae) as an active photoprotective process under high irradiance. Journal of Physiology. 2003; 39:1116-1124.
24. Wang Sh, Milton F, Hu S. Proteomic analysis of molecular response to oxidative stress by the green alga Haematococcus pluvialis (Chlorophyceae). Planta. 2004; 220; 17-29.
25. Pentecost A. Order Volvocales. In: The Freshwater Algal Flora of the British Isles. An identification guide to freshwater and terrestrial algae. John, D.M., Whitton, B.A. & Brook, A.J. Eds. Cambridge: Cambridge University Press. 2002.
26. Melten D, Imamoglu E, Demirel Z. Agricultural fertilizers as economical alternative for cultivation of Haematococcus pluvialis.. J Microbiol. Biotechnol. 2007; 17: 393-397.
27. Chojnacka K, Márquez R F. Kinetic and Stochiometric Relationships of the energy and carbon metabolism in the culture of Microalgae . Biotechnology.2004; 3: 21-34.
28. Lababpour A, Gyun Lee C. Simultaneous Measurements of Chlorophyll and Astaxanthin in Haematococcus pluvialis cells by first order derivative ultraviolet-visible Spectrophotometry. Journal of Bioscience and Bioengineering. 2006; 101:104-110.
29. Vidhyavathi R, Venkatachalam L, et al. Regulation of carotenoid byosinthetic genes expression and carotenoid accumulation in the green alga Haematococcus pluvialis under nutrient stress conditions. Journal of Experimental Botany.2008; 59: 1409-1418.
30. Boussiba S, Bing W, Yuan J, Zarka A, Chen F. Changes in pigments profile in the green alga Haeamtococcus pluvialis exposed to environmental stresses. Biotechnology Letters. 1999;21:601-604 .
31. Hata N, Ogbonna J, Hasegawa Y, Taroda H, Tanaka H. Production of astaxanthin by Haematococcus pluvialis in a sequential heterotrophic-photoautotrophic culture Journal of Applied Phycology. 2001;13: 395-402.
32. Orosa M, Franqueira D, Cid A, Abalde J. Carotenoid accumulation in Haematococcus pluvialis in mixotrophic growth. Biotechnology Letters. 2001; 23: 373-378.
33. Zhekisheva M, Boussiba S, Khozin-Golberg I, Zarka A, Cohen Z. Accumulation of oleic acid in Haeamtococcus pluvialis (Chlorophyceae) under nitrogen starvation or high light is correlated with that of astaxanthin esters. J. Phycology. 2002; 38: 325-331.
34. Cifuentes A, González M, Vargas S, Hoeneisen M, González N. Optimization of biomass, total carotenoids and astaxanthin production in Haematococcus pluvialis Flotow strain Steptoe (Nevada, USA) under laboratory conditions Biol Res. 2003; 36: 343-357.
35. Brinda B, Sarada R, Kamath B, Ravishankar G. Accumulation of astaxanthin in flagellated cells of Haematococcus pluvialis cultural and regulatory aspects. Current Science. 2004; 87(10).
36. Jeon Y, Cho Ch, Yun Y. Combined effects of light intensity and acetate concentration on the growth of unicellular microalga Haematococcus pluvialis Enzyme and Microbial Technology. 2006; 39:490-495.
37. Suh I, Joo H, Gyun Lee H. A novel double-layered photobioreactor for simultaneous Haematococcus pluvialis cell growth and astaxanthin accumulation. Journal of Biotechnology. 2006;125:540-546.
38. Domínguez-Bocanegra R, Ponce-Noyola T, Torres-Muñoz J. Astaxanthin production by Phaffia rhodozyma and Haematococcus pluvialis: a comparative study Appl Microbiol Biotechnol. 2007; 75: 783-791.
39. Kaewpintong K, Shotipruk A, Powtongsook S, Pavasant P. Photoautotrophic high-density cultivation of vegetative cells of Haematococcus pluvialis in airlift bioreactor Bioresource Technology. 2007; 98: 288-295.
40. Kang C,. Lee J, Park T,. Sim S. Complementary limiting factors of astaxanthin synthesis during photoautotrophic induction of Haematococcus pluvialis: C/N ratio and light intensity. Appl Microbiol Biotechnol. 2007; 74: 987-994.
41. Ukibe K, Hashida K, Yoshida K, Takagi H. Metabolic Engineering of Saccharomyces cerevisiae for Astaxanthin production and oxidative stress tolerance. Applied and Environmental Microbiology. 2009; 75: 7205-7211.
42. Wang J, Sommerfeld M, Hu Q. Occurrence and environmental stress responses of two plastid terminal oxidases in Haematococcus pluvialis (Chlorophyceae). Planta. 2009; 230: 191-203.
43. Li F, Vallabhaneni R, Wurtzel T. PSY3, a New Member of the Phytoene Synthase Gene Family Conserved in the Poaceae and Regulator of Abiotic Stress-Induced Root Carotenogenesis. Plant Physiology. 2008; 146:1333-1345.
44. Welsch R, Wüst F, Bär C, Salim Ai, Beyer P. A Third Phytoene Synthase Is Devoted to Abiotic Stress-Induced Abscisic Acid Formation in Rice and Defines Functional Diversification of Phytoene Synthase Genes. Plant Physiology. 2008; 147: 367-380.
45. Fraser P, Shimada H, Misawa N. Enzymic confirmation of reactions involved in routes to astaxanthin formation, elucidated using a direct substrate in vitro assay Eur. J. Biochem. 1998; 252: 229- 236.
46. Hagen C, Gru K, Schmidt S, Muller J. Accumulation of secondary carotenoids in agellates of Haematococcus pluvialis (Chlorophyta) is accompanied by an increase in per unit chlorophyll productivity of photosynthesis. Eur. J. Phycol.2000;35: 75- 82.
47. Katsuda T, Shimahara K, Shiraishi H, Yamagami K, Ranbjar R, Katoh S. Effect of flashing light from blue light emitting diodes on cell growth and Astaxanthin production of Haematococcus pluvialis. Journal of Bioscience and Bioengineering. 2006; 102: 442-446.
48. Tran N, Park J, Kim Z, Lee Ch. Influence of Sodium Orthovanadate on the Production of Astaxanthin from Green Algae Haematococcus lacustris Biotechnology and Bioprocess Engineering. 2009; 14: 322-329.
49. Sarada R, Vidhyavathi R, Usha D, Ravishankar G. An Efficient Method for Extraction of Astaxanthin from Green Alga Haematococcus pluvialis J. Agric. Food Chem. 2006; 54: 7585−7588.
50. Vidhyavathi R, Sarada R, Ravishankar G A. Expression of carotenogenic genes and carotenoid production in Haematococcus pluvialis under the influence of carotenoid and fatty acid synthesis inhibitors. Enzyme and Microbial Technology. 2009; 45 :88-93.
51. Pizarro L, Stange C. Light-dependent regulation of carotenoid biosynthesis in plants. Cien. Inv. Agr.2009; 36: 143-162