Purificación rápida de inmunoglobulina M a partir de suero de cachama blanca (piaractus brachypomus) y preparación de antisuero policlonal en conejo
Francy J. Montoya1, Jorge E. Almansa2, Sandra Parada3, Pedro René Eslava3, Alfredo Arias3, Rubén Darío Toro1, Joyce Andrea Rojas.
1Corpoica, Ceisa, Bogotá.
2Programa Estratégico de Investigación Biomédica, Universidad Antonio Nariño, Bogotá.
3Instituto de Acuicultura de la Universidad de los Llanos Orientales, IALL.
Correspondencia: jorge.almansa@uan.edu.co
Recibido: 07-03-07 / Aceptado: 10-15-07
Para este fin, se purificaron gammaglobulinas mediante su elusión a partir de geles de agarosa, se confirmaron la presencia de dos posibles agregados de IgM, y la confiabilidad de este método de purificación que nos permite obtener pequeñas cantidades de proteína sin la presencia de contaminantes. Los antisueros obtenidos reaccionaron exclusivamente contra la fracción de las gammaglobulinas, lo que se comprobó mediante la técnica de inmunoelectroforesis. Además se obtuvieron con SDS – PAGE bajo condiciones sin reducción dos bandas: la primera con un peso aproximado de 80 kDa y la segunda de 70 kDa, y bajo condiciones reducidas también dos bandas: la primera con un peso aproximado de 90 kDa y la segunda de 70 kDa.
Palabras claves: cachama, electroforesis, gammaglobulinas, ictiopatología, inmunoglobulinas, inmunización.
For this end, gamma-globulins were purified by means of the elution starting from agarosa gels. The presence of two possible attachés of IgM was confirmed. One of them seems to correspond to form monomerics and the dependability of this purification method allows us to obtain small quantities of protein without the presence of pollutants. The reactivity of the obtained antiserum only reacted against the fraction of the gamma-globulins, what was proven by means of the inmunoelectroforesis technique with the serums of White Cachama. Also, they obtained two bands with SDS - PAGE under conditions without reduction; the first one with an approximate weight of 80 kDa and the second one about 70 kDa. Under reduced conditions, two bands were obtained, the first one with an approximate weight of 90 kDa and the second of 70 kDa.
Key Words: cachama, electrophoresis, gamma-globulines, ictiopathology, immunization, immunoglobulins,
En los últimos años el cultivo de cachama, actividad piscícola que explota principalmente los géneros Piaractus y Colossoma nativos de la Orinoquía y Amazonía Sudamericana, ha contribuido exitosamente al desarrollo regional de la acuicultura, como consecuencia de las bondades demostradas por estos peces en condiciones de cultivo (1,2). En los últimos veinte años la producción mundial de especies como tilapia, trucha y cachama ha crecido a ritmos de 12%, 6% y 29% respectivamente. Es importante anotar que la producción de tilapia, trucha y cachama corresponde al 96,3% de la actividad piscícola colombiana y al 65.3% de la producción acuícola. Mientras que para el año 1995 la producción nacional de cachama se calculaba en 3.181 toneladas, en el año 2003 estuvo cercana a las 9.000 toneladas lo que consolidó a Colombia como el segundo productor mundial, después de Brasil (3).
A pesar de que la cachama es reconocida por su rusticidad y resistencia a las enfermedades, la tendencia creciente hacia la intensificación de los sistemas de producción de la especie, comienzan a favorecer el aumento de problemas sanitarios, los cuales deberán ser caracterizados a fin de poder establecer métodos de diagnóstico y planes de prevención racionales. Por otra parte, el conocimiento ictiopatológico de especies nativas es incipiente, entre otras cosas porque la disponibilidad de información sobre aspectos básicos de histología, embriología, fisiología, anatomopatología, inmunología y epidemiología es escasa, lo que hace necesario el establecimiento de proyectos de investigación que permitan conocer tales aspectos a fin de apoyar técnicamente la producción de estas especies.
Un aspecto fundamental en el estudio de estas especies recientemente involucradas en procesos de producción industrial lo constituye el sistema inmunológico, ya que gracias a su conocimiento y manipulación es posible prevenir y diagnosticar un gran número de enfermedades de tipo infeccioso. Dentro de ese marco, la purificación de inmunoglobulinas representa un desarrollo básico que puede conducir a la preparación de antisueros o anticuerpos monoclonales de múltiples utilidades. En aves y mamíferos, en donde se presenta más de un isotipo de estas moléculas, cuyas migraciones electroforéticas se sobreponen haciendo difícil su separación completa y así también su posible elución en estado de pureza, es necesaria la aplicación de un sinnúmero de procedimientos que incluyen precipitación en salado, diálisis, cromatografías de intercambio iónico, afinidad y filtración, entre otros, que requieren a su vez la disponibilidad de equipamiento diverso y costoso. Vale anotar que estos procedimientos empleados en la purificación de inmunoglobulinas de mamíferos y aves, se han utilizado con éxito en la obtención de anticuerpos de peces, pero a un costo muy elevado.

Figura 1. Ejemplar adulto de Cachama Blanca (Piaractus brachypomus)
Dado que en peces se ha reportado la presencia únicamente de la IgM y que esta puede separarse de manera nítida en electroforesis que emplean distintas matrices tales como acetato de celulosa o agarosa, su elución se podría realizar fácilmente. En el presente trabajo se presenta la metodología básica para la purificación de IgM de cachama blanca Piaractus brachypomus a partir de proteína sérica separada por electroforesis en geles de agarosa, eluida en una columna de giro, y la subsiguiente preparación de un antisuero policlonal anti IgM en conejo, Figura 1. La pureza de la IgM aislada se comprobó por medio de inmunoelectroforesis (IEF), inmunofijación y electroforesis en gel de poliacrilamida. Se discute la metodología y su aplicación en posteriores estudios inmunológicos.
Electroforesis en acetato de celulosa
La electroforesis en acetato de celulosa se realizó empleando el sistema Sepratek â (Gelman sciences, Inc. Am Arbor Michigan 48106) y la metodología descrita por Ingram en 1990, en una solución amortiguadora de barbital sódico pH 8,6 durante 20 minutos a 250 voltios, las membranas se tiñeron con rojo Ponceau, se decoloraron en solución aclarante (10 mL de ácido acético glacial en 90 mL de metanol anhídrido) (4).
Purificación de inmunoglobulina M (IgM)
La electroforesis en agarosa se realizó con el sistema Biomax (CBS Scientific Co. No. MGU200T), según la metodología descrita por Ingram. En agarosa al 0,9% se sometieron los sueros a electroforesis, en el buffer barbital sódico pH 8,6 durante 30 minutos a 250 voltios, se cortaron las dos primeras líneas de corrida del gel, se colorearon con rojo Ponceau y se decoloraron con ácido acético al 5%, se realizaron los cortes de la banda de las gammaglobulinas teniendo como patrón las líneas previamente cortadas y coloreadas. La banda cortada se maceró suavemente, se dispensó en viales eppendorf los cuales tenían un orificio en la base del tubo, estos tubos se colocaron dentro de tubos falcón de 15 mL y se centrifugaron a 1000 rpm por 5 minutos obteniendo la Ig M purificada (4).
Inmunoelectroforesis (IEF)
La inmunoelectroforesis se llevó a cabo utilizando el sistema LKB (Power suply Tipe 329) con agarosa al 0,9%, en una solución amortiguadora de Buffer Tris Bórico EDTA (TBE) pH 8,6, se dispensaron los sueros purificados en los pozos y se sometieron a electroforesis a 150 voltios por 90 minutos. Se retiró la canaleta central y se sirvió el antisuero total o anti IgM y se dejó en difusión en cámara húmeda por 72 horas a temperatura ambiente. Se realizó un lavado con solución salina 0,85% y otro con agua destilada, cada uno por un periodo de 24 horas, se secaron las láminas, se tiñeron con rojo Ponceau y se decoloraron con ácido acético al 5%.
Producción de antisuero
Se inmunizaron 4 conejos, dos con suero total y dos con la inmunoglobulina M purificada utilizando el calendario de inmunización largo descrito por Rodríguez y colaboradores en 1978 (5). Dos de ellos de inocularon el día 0 con suero total 1:4 en PBS emulsificado 1:1 con adyuvante completo de Freund (ACF) en un volumen total de 1 mL y los otros dos animales con 100 mg/mL de IgM purificada emulsificada 1:1 con ACF en un volumen total de 1 mL, se aplicó un refuerzo a los 25 días con los antígenos preparados en adyuvante incompleto de Freund (AIF) por vía intramuscular y se inocularon refuerzos los días 45, 55 y 65, con antígenos preparados en solución salina estéril 0,85% e inoculados por vía intravenosa.
Electroforesis de poliacrilamida SDS – PAGE
La IgM purificada fue sometida a electroforesis en geles de 7,5% de poliacrilamida (7,5cm x 6,5cm), en una cámara para electroforesis vertical (Miniprotean II – BIO-RAD) según protocolo descrito por Laemmli en 1970, a 35 voltios por 5 horas aproximadamente, se colorearon con azul de Coomasie y se decoloraron con ácido acético al 10% (6).
Con el propósito de iniciar el proceso de caracterización de la IgM purificada, se realizaron corridas electroforéticas en geles de poliacrilamida en condiciones reductoras y no reductoras. Bajo condiciones sin reducción se presentaron dos bandas, la primera con un peso aproximado de 80 kDa y la segunda de 70 kDa Figura 4 y con reducción se observan dos bandas, la primera con un peso aproximado de 90 kDa y la segunda de 70 kDa Figura 5. Los resultados de precipitación y de las electroforesis sugieren que podrían existir dos tipos distintos de cadenas pesadas en cada monómero de inmunoglobulina, unidas muy débilmente, por lo que no se producen fenómenos de precipitación.
De la misma manera existirían dos tipos distintos de IgM, posiblemente una correspondería a un monómero de IgM, tal como lo reportan para carpa (13), y para algunos teleósteos (14). Sin embargo, los procesos de detección de anticuerpos y los estudios estructurales de las inmunoglobulinas de la cachama deben continuar en una segunda fase con el fin de aclarar la estructura.
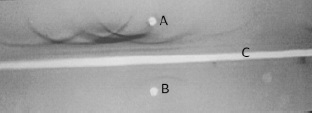
Figura 2. Inmunoelectroforesis. A. Suero total de cachama. B. IgM purificada de suero de cachama y C. Antisuero total de cachama blanca (Piaractus brachypomus). Se observa en el numeral A la distribución proteica del suero total y en el numeral B la presencia de un arco de precipitación en la región de las gammaglobulinas.

Figura 3. Inmunoelectroforesis. A. Suero total de cachama. B. IgM purificada de suero de cachama y C. Antisuero anti IgM de cachama blanca (Piaractus brachypomus). Se observa en el numeral A dos arcos sobrepuestos de diferentes agregaciones de Ig M y en el numeral B la presencia de un arco de precipitación en la región de las gammaglobulinas.
Como se sabe, la dificultad para eluir cantidades pequeñas de proteínas puras a partir de métodos electroforéticos en sueros de mamíferos reside en el traslapo en la región gamma de las inmunoglobulinas G, A y M principalmente, y en la presencia de algunas de estas inmunoglobulinas en la interfase beta-gamma. En los peces, este fenómeno no se presenta ya que sólo se ha detectado la IgM y, en el caso concreto de la cachama, en la región gamma aparecen dos bandas, como pudo constatarse en este estudio, que parecen reflejar la presencia de dos tipos distintos de asociación entre monómeros de la inmunoglobulina M (10). Esas mismas bandas son reconocidas en la inmunoelectroforesis contra la inmunoglobulina como dos arcos sobrepuestos, Figura 3. El método de purificación propuesto en este trabajo representa una alternativa rápida y económica a los sistemas tradicionales de obtención de IgM, más laboriosos, costosos, con mayor utilización de equipos y sin duda, más demorada.
De otra parte, los antisueros contra inmunoglobulinas constituyen un reactivo biológico de gran ayuda en el montaje de distintas pruebas diagnósticas y de localización tanto serológicas como en tejidos, que van desde las aglutinaciones hasta las más sofisticadas y sensibles, que podrían emplear tales anticuerpos como secundarios, una vez se han marcado con sustancias como enzimas o fluorocromos. Otra utilidad de estos antisueros se encuentra en estudios básicos de caracterización fenotípica y funcional de algunas poblaciones celulares. Dado que la cachama blanca constituye una especie industrialmente promisoria y que se encuentra apenas en proceso de reconocimiento de su potencial, es aconsejable la realización de estudios tendientes a conocer mejor su comportamiento y constitución inmunológica, para lo cual, estos antisueros pueden contribuir notablemente.

Figura 4. SDS – PAGE sin reducción; coloreado con azul de Coomasie Izquierda marcador de peso molecular. Derecha Ig M purificada de suero de cachama blanca (Piaractus brachypomus).

Figura 5. SDS – PAGE reducido; coloreado con azul de Coomasie Izquierda marcador de peso molecular. Derecha Ig M purificada de suero de cachama blanca (Piaractus brachypomus).
Adicionalmente, se intentó producir un antisuero en cachama utilizando esquemas de inmunización largos, con albúmina bovina y antígeno Gp-51 del virus de la leucosis bovina. Sin embargo no se pudieron detectar anticuerpos reactivos por técnicas de inmuno-difusión doble. Más adelante se preparó antígeno de Aeromonas hydrophila de acuerdo con el protocolo establecido por Coeurdacier y colaboradores en 1997 con resultados similares (11). A pesar de que los controles realizados para las pruebas con antisueros preparados en conejo resultaban positivos tras las primeras inoculaciones, en cachama fue imposible detectar, por esa metodología, la presencia de anticuerpos reactivos.
Las técnicas de precipitación en acetato de celulosa y agarosa son usadas rutinariamente para detectar la presencia de antígenos y anticuerpos en estudios inmunológicos en peces, sus resultados parecen ser inexactos y algunos investigadores han encontrado que en general, los peces no producen anticuerpos precipitantes. Así, una reacción positiva depende no solo del antígeno, sino del tipo de pez inoculado (12). De otra parte, se ha establecido que los peces presentan linfocitos B que podrían ser considerados funcionalmente homólogos a los CD5 o LB1 de vertebrados superiores. De ser así, la respuesta de tales linfocitos sería estimulada básicamente por polisacáridos y los anticuerpos generados serían polirreactivos. Por esta razón se propuso utilizar además de dos proteínas, una bacteria en los esquemas de inmunización. Como una prueba adicional se realizó una inmunoprecipitación empleando Anti IgM preparada en conejo y suero total de cachama. Esta técnica no permitió observar precipitación.
Los resultados obtenidos en esta investigación permiten anotar, a manera de conclusión, lo siguiente: la técnica de purificación de gammaglobulinas en cachama blanca (Piaractus brachypomus) mediante elución a partir de electroforesis en geles de agarosa, es un método confiable que facilita obtener pequeñas cantidades de proteína sin la presencia de contaminantes. Existirían dos formas diferentes de agregación de inmunoglobulinas M en la fracción de las gammaglobulinas, de las cuales una parece corresponder a formas monoméricas.
El antisuero anti Inmunoglobulina M presentó reactividad únicamente contra las gammaglobulinas, lo cual fue comprobado mediante la técnica de inmunoelectroforesis para los sueros de cachama blanca (Piaractus brachypomus). Con la técnica de inmunodifusión doble no es posible detectar anticuerpos precipitantes para cachama blanca (Piaractus brachypomus) contra antígenos proteicos puros, ni contra antígenos crudos de origen bacteriano. Las inmunoglobulinas M corridas en PAGE bajo condiciones sin reducción presentaron dos bandas, la primera con un peso aproximado de 80 kDa y la segunda con un peso aproximado de 70 kDa.
Las Inmunoglobulinas M corridas en PAGE bajo condiciones de reducción presentan dos bandas, la primera con un peso aproximado de 90 kDa y la segunda con un peso aproximado de 70 kDa. Estos resultados podrían estar determinados por la presencia de dos tipos distintos de cadena pesada para la IgM. La falta de reactividad de la Igs de cachama blanca puede deberse a la frágil unión entre las cadenas pesadas en los monómeros de Ig. La inmunización de conejos siguiendo los esquemas planteados constituye una metodología eficaz para la producción de antisuero total y de proteínas purificadas de cachama blanca (Piaractus brachypomus).