
El pulque: características microbiológicas y contenido alcohólico mediante espectroscopia Raman.
Mario Cervantes-Contreras1, Aura Marina Pedroza-Rodríguez2
1Departamento de Matemáticas, Unidad Profesional Interdisciplinaria de Biotecnología-Instituto Politécnico Nacional, Ticoman, México D. F. 07340, México.
2Grupo de Biotecnología Ambiental e Industrial. Laboratorio de Biotecnología Aplicada. Departamento de Microbiología. Pontificia Universidad Javeriana.
Correspondencia: cecontreras@ipn.mx, apedroza@javeriana.edu.co
Recibido: 10-05-07 / Aceptado: 12-05-07
El contenido alcohólico varió en función del tiempo de fermentación alcanzando porcentajes de 10.35 (v/v) y 9.01 (v/v) determinados por cromatografía de gases y espectroscopia Raman para la etapa denominada «corrida». El producto terminado tiene un elevado contenido de proteínas (1 g/L), azúcares reductores (4.75 g/L) y poblaciones microbianas en ordenes de 45x108 UFC/mL para Saccharomyces sp, 41x107 UFC/mL para Zymomonas sp y 34x106 UFC/mL para Lactobacillus sp, que le dan a la bebida un elevado valor nutricional y los microorganismos aislados podrían tener un efecto benéfico sobre sistema digestivo al ser consumido por vía oral.
Palabras claves: espectroscopia Raman etanol, Lactobacillus sp, probióticos, pulque, Saccharomyces sp, Zymomonas spl.
The alcohol content varies in function of the fermentation time reaching percentages of 10.35 % (v/v) and 9.01 % (v/v) in the so called «run» stage. They are determined by gas chromatography and Raman spectroscopy. The end product has a high content of proteins (1 g/l), sugar reducers (4.75 g/l) and microbial populations in ranks of 45x108 UFC/mL for Saccharomyces sp., 41x107 UFC/mL for Zymomonas sp and 34x106 UFC/mL for Lactobacillus sp, that give the drink a high nutritional value. The microorganisms could be beneficial to the digestive system when ingested orally.
Keywords: ethanol, Lactobacillus sp., probiotics, pulque, Raman spectroscopy, Saccharomyces sp, Zymomonas sp.
El proceso de fermentación inicia en el maguey, donde se encuentran microorganismos autóctonos como levaduras, bacterias lácticas, bacterias productoras de etanol y bacterias productoras de exopolisacaridos (2).
Estos microorganismos transforman de manera natural parte de los azúcares disponibles en aguamiel, sin embargo el proceso se acelera por la adición de un inoculo iniciador llamado semilla (una porción de pulque previamente producido). El tiempo de fermentación puede durar de 12 a 48 hora a 25º C, cuidando que los recipientes no tenga ninguna sustancia que inhiba los microorganismos mesofílicos (Detergentes, perfumes, desinfectantes, entre otros). A medida que pasa el tiempo se presentan cambios importantes como un incremento en el porcentaje de etanol y formación de exopolisacaridos como b-glucanos y dextranos; que generan un incremento en la viscosidad transformado el fluido de newtoniano a no newtoniano (3).
Los consorcios microbianos son frecuentemente encontrados en varias bebidas fermentadas y se considera que esta interacción positiva es un mecanismo evolutivo que favorece a todas las poblaciones presentes en el consorcio con respecto a la captación de nutrientes, eliminación de ciertos metabolitos que pueden llegar a ser tóxicos si se acumulan en la bebida y control de flora microbiana alterante de la fermentación (4).
La literatura reporta que a partir del pulque se pueden recuperar diversos grupos microbianos clasificados como: subdivisión Bacillus-Lactobacillus-Streptococcus (Lactobacillus cepa ASF360 AF157050, Lactobacillus acidophilus M99740, L. hilgardii M58521, L. plantarum D79210 y Leuconostoc mesenteroides spp mesenteroides), subdivisión proteobacteria (Acetobacter pomorium AJ001632, Zymomonas mobilis AF281034) y hongos levaduriformes pertenecientes a los géneros (Sacharomyces cerevisiae, Saccharomyces sp) (2).
El producto terminado es una bebida alcohólica que puede tener propiedades probióticas. Esta característica fue documentada desde épocas prehispánicas, «El enema a base de pulque más antiguo conocido en Mesoamérica procede de Xochipala, Guerrero, México, data de 1200 a 900 a.C., aproximadamente». El uso de enemas contra enfermedades y dolencias del tracto digestivo en las culturas prehispánicas se registra por evidencias arqueológicas y por recopilaciones coloniales (5,6). Actualmente se conoce el efecto benéfico de ciertos grupos microbianos sobre el sistema digestivo de humanos y animales.
Estos consorcios microbianos ingeridos por vía oral pueden actuar a diferentes niveles. La reducción de enzimas como nitroreductasas, azoreductadas y glucoronidasas que se han asociado con ciertos tipos de cáncer gástrico; efecto antimicrobiano por la producción de ácidos orgánicos, enzimas, bacteriocinas y competencia por nutrientes con los patógenos intestinales (7,8). Dentro de los grupos con actividad probiótica que se recuperan del pulque se destacan los géneros Zymomonas sp, Lactobacillus sp y en algunos casos Saccharomyces sp.
En el presente artículo se realizó un estudio microbiológico de las diferentes etapas de fermentación durante la producción artesanal de pulque; para evaluar el comportamiento de las poblaciones presentes y su efecto sobre los compuestos mayoritarios como carbono y nitrógeno. Se implementó un método físico para determinar el contenido de etanol, mediante el análisis de los espectros de dispersión Raman, para utilizarlo como índice de calidad química en esta bebida, realizando una comparación con técnicas tradicionales como cromatografía de gases.
Finalmente se aislaron e identificaron los grupos microbianos más representativos, los cuales son responsables de la fermentación alcohólica, cambios de viscosidad y han sido reportados como microorganismos con efecto probiótico.

Figura 1. Proceso de elaboración del pulque. (A) Penca de maguey en producción, (B) Raspado de la penca de maguey, (C) Aguamiel obtenida de la penca, (D) preparación de la semilla, (E) Mezcla de la semilla y el aguamiel, (F) Corrida ó pulque maduro.
El aguamiel corresponde al líquido extraído de la cepa del maguey, la semilla es un pulque con fermentación de alrededor de 60 días, la contrapunta es un pulque de 24 horas de fermentación obtenido por una mezcla 1:1 de aguamiel y semilla. La corrida corresponde a un pulque de 48 horas de fermentación, esta es la etapa final y el producto se comercializa en la zona. Las muestras se transportaron refrigeradas y se procesaron durante las 24 horas siguientes, Figura 1.
Aislamiento primario
Cada una de las muestras pertenecientes a las diferentes etapas del proceso se diluyeron en forma seriada desde 10-1 hasta 10-6, empleando agua peptonada al 0.1% (p/v). La siembra se realizó por la técnica de microgota (9); sembrando 20 mL de cada dilución en agar YPG (10), agar LW (11) y Agar MRS suplementado con 20% (p/v) de sacarosa y 0.0001% (p/v) de púrpura de bromocresol (12). Las cajas se incubaron por 72 horas para bacterias y 5 días para hongos a una temperatura constante de 25ºC manteniendo condiciones de microaerofília.
Posteriormente se realizó el recuento de colonias expresado como UFC/mL y se seleccionaron las más representativas de los tres grupos tomando como base el porcentaje de recuperación en todas las etapas. La purificación de colonias se llevó a cabo por medio de pases sucesivos en los mismos medios. La morfología microscópica se visualizó por medio coloración de Gram y observaciónes con lente de 100x siguiendo la metodología descrita por Meza y colaboradores (13).
Tabla 1. Identificación bioquímica
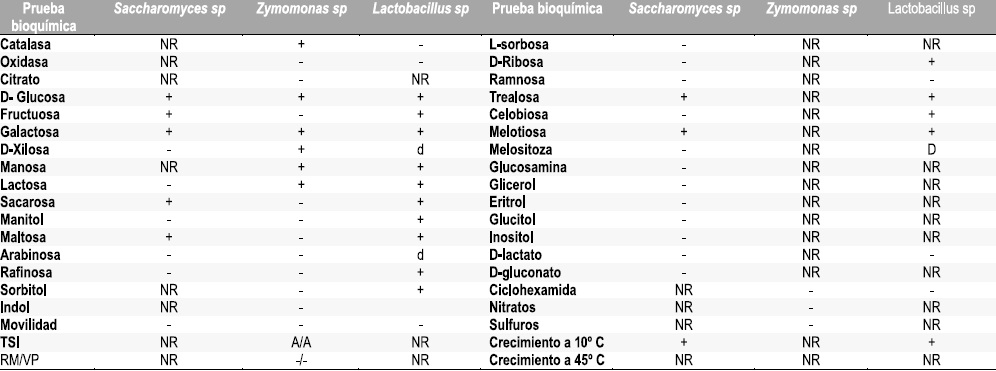
Identificación bioquímica
La Identificación bioquímica de las levaduras, bacilos Gram positivos y cocobacilos Gram negativos aislados por pases sucesivos se realizaron siguiendo pruebas tradicionales según los reportado por Bergey 1984, Tabla 1.
Microscopia electrónica de barrido
La población predominante en todas las etapas del proceso fue seleccionada para realizar microscopía electrónica de barrido (MEB) empleando un microscopio de la marca JEOL JSM- 6300, que proporcionó amplificaciones de hasta 300000X. Las muestras fueron observadas directamente sin hacer recubrimiento con oro, obteniéndose imágenes de 1500X y 3000X, con un voltaje de 5 kV (15).
Cuantificación de etanol
La cuantificación de etanol se realizó por medio de cromatografía de gases de acuerdo a la técnica reportada por Ríos y Calva, 1999. Las muestras fueron centrifugadas por 15 minutos a 5000rpm, se recuperó el sobrenadante y se inyectó en el cromatógrafo. Los valores de porcentaje fueron calculados empleando una curva de calibración de etanol previamente estandarizada (16).
Espectroscopia Raman
Un conjunto de muestras de solución agua/etanol con diferentes porcentajes de etanol fueron preparadas para construir un modelo de referencia, obteniéndose una curva de calibración, la cual se empleó para calcular los porcentajes de etanol en las muestras del pulque.
Se empleó etanol de 99.9% de pureza y agua bidestilada. Las muestras fueron preparadas obteniéndose mezclas con porcentajes de 0.1% a 20% y 100% (v/v) de etanol. Los espectros Raman se obtuvieron mediante una geometría de retrodispersión en un sistema microRaman LABRAM, el cual es un sistema Raman integrado. Tiene un microscopio acoplado para el espectrógrafo con una longitud focal de 300 mm. Adicionalmente posee un láser interno de HeNe de 20 mW, el cual se utilizó para excitar la muestra. Se empleó un objetivo de 50X y la señal fue analizada con un detector CCD. Los espectros Raman de agua/etanol y del pulque se obtuvieron en un rango de 300 cm-1 a 1700 cm1 a temperatura ambiente, incidiendo el láser sobre un volumen de 2 mL.
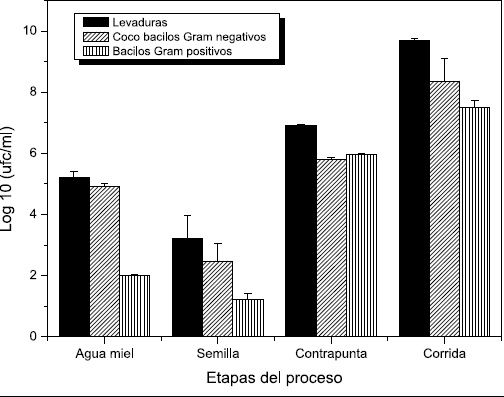
Figura 2. Recuento de poblaciones recuperadas en cada etapa del proceso de elaboración del pulque. Siembra por microgrota en agar YPG (Levaduras), Agar LW (Cocobacilos Gram negativos) y agar MRS (Bacilos Gram positivos). Incubación por dos y cinco días a 25ºC.
Otras determinaciones analíticas
La cuantificación de azúcares reductores totales se realizó por medio de la técnica colorimétrica de oxidoreducción del ácido 3,5-dinitrosalicílico (17), empleando glucosa anhidra como patrón. Las muestras se centrifugaron 20 minutos a 5000 rpm y se tomó el sobranadante para llevar a cabo la reacción. Los resultados presentados corresponden al promedio de tres repeticiones. El contenido total de proteínas se realizó por la técnica colorimétrica de Bradford, empleando albúmina de suero bovino como patrón (18).
En la etapa final ó corrida se observó un aumento significativo (p<0.05) en todos los grupos con recuentos de 50x108 UFC/mL, 41x107 UFC/mL y 34x108 UFC/mL para hongos levaduriformes, cocobacilos Gram negativos y bacilos Gram positivos.

Figura 3. Características microscópicas con coloración de Gram. (A) Cocobacilos Gram negativos, (B) Hongo levaduriforme, (C) Bacilos Gram postivos productores de expolisacarido. Aumento de 100x.
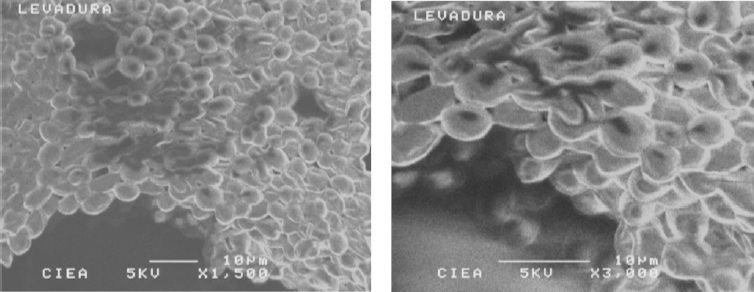
Figura 4. Microscopía electrónica de barrido de la etapa denominada corrida. Aumento 1500x y 3000x. Muestras preparadas en fresco sin recubrimiento con oro.
Con respecto a las morfologías macroscópicas, las colonias para cada género presentaron tres formas características, las primeras eran colonias de color blanco, cremosas, de borde regular y gran tamaño; el segundo grupo se desarrolló formando colonias pequeñas, puntiformes y traslucidas. El último grupo se caracterizó por crecer en forma de colonias grandes mucoides semitransparentes.
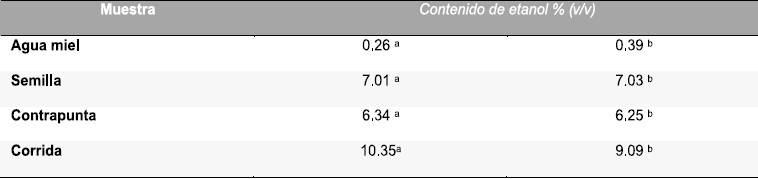
Tabla 2 .Concentraciones de etanol para las cuatro diferentes etapas de fermentación, obtenidas mediante espectroscopia de gasesa y a través de los espectros de espectroscopia Ramanb.
En las Figuras 3 (A), (B) y (C) se observan las características microscópicas obtenidas por medio de la coloración de Gram la cual permitió visualizar las morfologías típicas de cocobacilos Gram negativos, células levaduriformes, y bacilos Gram positivos, respectivamente. En la Figura 4 se observa la imagen obtenida por microscopía electrónica de barrido de las células levaduriformes que fueron las que se recuperaron en mayor proporción con porcentajes de 20%, 12%, 27% y 41% en el aguamiel, semilla, contrapunta y corrida respectivamente.
Identificación bioquímica
Las tres colonias aisladas presentaron características macroscópicas, microcoscópicas y bioquímicas iguales a lo reportado para los géneros Saccharomyces sp, Zymomonas sp y Lactobacillus sp, Tabla 2.
Cuantificación de azúcares reductores totales, proteínas y etanol
Empleando las técnicas colorimétricas de Miller (17) y Bradford (18) se cuantificó la concentración en g/L de azúcares reductores totales y proteínas. Encontrando que al inicio del proceso (aguamiel) se presentó la mayor cantidad de azúcares y proteínas a razón de 25 g/L y 3.7 g/L lo que demuestra que el aguamiel es un sustrato nutricionalmente enriquecido que favorece el crecimiento de poblaciones microbianas; las cuales utilizan los compuestos del aguamiel como fuente de carbono y energía para producción de nuevas células, acompañado de la formación de productos de la fermentación. Como se observa en la Figura 5, el contenido de azúcar y proteína va disminuyendo en función del tiempo de fermentación, sin embargo no llega a ser consumido en su totalidad es por esto que el pulque al final del proceso ó etapa denominada como corrida tiene un ligero sabor dulce, contenido de proteína y etanol. En un pulque de 48 horas de fermentación el contenido de etanol fue de 10.35 % (v/v), 4.76 g/L de azúcares reductores y 1 g/L de proteína. Los porcentajes de etanol obtenidos mediante cromatografía de gases se muestran en la Tabla 2.
Concentraciones de etanol obtenidas mediante espectroscopia Raman.
En la Figura 6 se presentan los espectros Raman de las cuatro muestras estudiadas comparadas con el espectro obtenido para una muestra de etanol al 100%. En esta figura se observan varias bandas de absorción, en particular las indicadas con flechas localizadas alrededor de 884 cm-1 (symmetric CCO stretching ) y 1054 cm-1; esta ultima se usaron para normalizar. Estas dos bandas se observaron en todos los espectros Raman del pulque y de las mezclas agua/etanol, incluyendo el de etanol 100 %. La cuantificación de los porcentajes de etanol se realizó calculando el área bajo la curva en estas dos bandas, obteniéndose la razón del área bajo la banda localizada en 884 cm-1 y el área bajo la banda localizada alrededor de 1054 cm-1.
Para las mezclas agua/etanol se realizó una gráfica de esta razón en función de la concentración de etanol, obteniéndose una relación lineal para concentraciones de 0.1% a 1 %. Un ajuste por mínimos cuadrados fue utilizado para obtener una relación lineal como curva de calibración de etanol, con un coeficiente de correlación de 0.97.
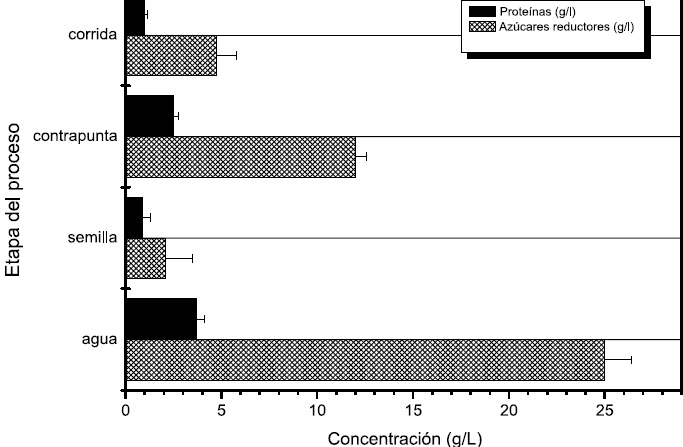
Figura 5. Concentración de proteínas y azúcares reductores durante cada etapa del proceso de fermentación artesanal de pulque.
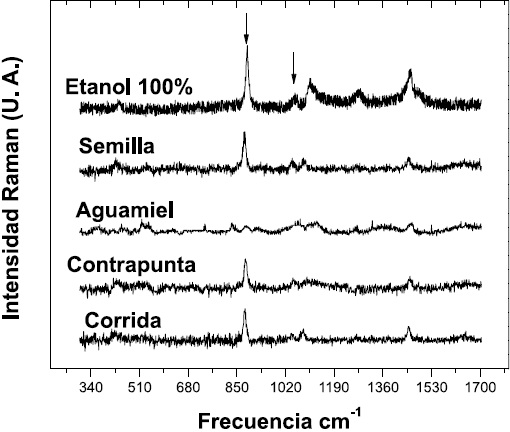
Figura 6. Espectros Raman de las cuatro muestras estudiadas junto con el espectro obtenido para la muestra con un 100% de etanol.
De igual forma en el intervalo de 3% a 20% se obtuvo una relación lineal de esta razón en función de la concentración de etanol. La curva de calibración obtenida para este intervalo fue una relación lineal con un coeficiente de correlación igual a 0.92. A partir de estas curvas de calibración se obtienen los porcentajes de etanol para las cuatro muestras estudiadas cuyos valores se resumen en la Tabla 2. Como se puede observar estos valores son muy similares a los obtenidos por el método de cromatografía de gases, demostrando que los dos métodos son reproducibles y la técnica de Raman puede ser empleada como método alterno, rápido y confiable para la determinación de muestras líquidas con composición química heterogénea.
Este resultado puede estar asociado con las características iniciales del aguamiel que es líquido fresco no fermentado rico en azúcares de fácil asimilación y proteínas que mantiene unas poblaciones autóctonas en espera de unas condiciones ambientales y nutricionales apropiadas para su propagación. Con respecto a la semilla se encontraron recuentos más bajos posiblemente porque este producto llevaba alrededor de 60 días de fermentación, tiempo en el cual las poblaciones han consumido la fuente de carbono y nitrógeno, determinando que pudieran entrar en fase estacionaria ó por el contrario se presentara la muerte celular por déficit de nutrientes (19).
En la etapa llamada contrapunta en la cual se mezcla en proporción 1:1 el agua miel y semilla, los recuentos de levaduras y bacterias incrementaron con valores promedio de 83x106 UFC/mL, para hongos levaduriformes, 61x104 UFC/mL para cocobacilos Gram negativos y 93x104 UFC/mL para bacilos Gram positivos, la respuesta positiva en las poblaciones pudo estar asociada a dos posibles causas. La primera, fue la adición de sustrato fresco rico en carbohidratos y proteínas a partir del cual las células pueden obtener carbono y energía reactivando el metabolismo y por consiguiente se observó un incremento poblacional. La segunda, hace referencia al aporte de aminoácidos, vitaminas y cofactores esenciales dados por la semilla. Es factible que tras 60 días de fermentación muchas células se lisaron y dejaron libre en el pulque estos componentes esenciales que fueron tomados por las nuevas poblaciones.
Esta combinación de factores y su efecto sobre las diferentes poblaciones se comprobó al analizar los resultados en la muestra identificada como corrida que corresponden a un pulque de 48 horas de fermentación. En esta etapa se observó un incremento significativo (p<0.05) en todos los grupos con recuentos de 50x108 UFC/mL, 41x107 UFC/mL y 34x108 UFC/mL para hongos levaduriformes, cocobacilos Gram negativos y bacilos Gram positivos. La posible explicación es el consumo de sustrato, formación de células y formación de producto (etanol). Un resultado interesante fue el incremento de bacilos Gram positivos; el cual se podría correlacionar con el aumento en la viscosidad, cambio físico típico en un pulque maduro.
Con respecto a la identificación bioquímica, los géneros recuperados con un 98% de probabilidad fueron Saccharomyces sp, Zymomonas sp y Lactobacillus sp. Estos resultados son similares al estudio realizado por Giannoutsou y colaboradores (20), quienes recuperaron Saccharomyces sp. empleando la misma batería de pruebas bioquímicas. Con respecto a Zymomonas sp los resultados concuerdan con la clasificación de género reportada por Matiz en el 2000.
Renouf y colaboradores en el 2006, reportaron que las bacterias acidolácticas (BAL) se recuperan a partir de diferentes bebidas fermentadas como cerveza, vino, cidra, entre otros. Dentro los géneros que identificó por técnicas moleculares se encuentran Lactobacllus sp, Pediococcus sp, Oenococcus oeni y Lecuconostoc mesenteroides; los cuales están asociados con la producción de exopolisacaridos compuestos de alto peso molecular formados por subunidades repetitivas de homoglucanos y heteroglucanos unidos por diferentes enlaces glucusídicos que le confiere a ciertas bebidas fermentadas a base de leche, frutas y vegetales con propiedades no newtonianas de tipo speudoplastico.
Los tres grupos responsables de la transformación bioquímica del agua miel también podrían ser los encargados de conferir un valor agregado a la bebida, su efecto probiótico.
Los investigadores del Centro de Investigación en Biotecnología Aplicada (CIBA) del Instituto Politécnico Nacional, en Tlaxcala, demostraron que los microorganismos aislados del pulque tienen capacidad de inhibir el crecimiento de ciertas bacterias patógenas como: Escherichia coli, Shigella sp, Salmonella sp. Dentro de los grupos aislados se reportó la presencia de los tres géneros recuperados en este estudio.
El aislamiento de microorganismos con efecto probiótico ha sido reportado en otras bebidas fermentadas; Todorov y Dicks (22) en el aislaron bacterias ácido lácticas productoras de bacteriocinas a partir de una bebida tradicional Búlgara denominada Boza, a partir de la cual Botes y su grupo en el 2007 demostraron que en la misma bebida se recuperó un consorcio estrechamente relacionado con la producción de etanol, características organolépticas y cambos de la viscosidad asociada con bacterias ácido lácticas y levaduras. Por otro lado, Paramithiotis y colaboradores, reportaron que Saccharomyces cerevisiae y bacterias ácido lácticas son las responsables de la fermentación viscosa y alcohólica de bebidas fermentadas de origen artesanal (23).
Sin embargo, la principal limitación para darle un mayor aprovechamiento a pulque y sus derivados; hace referencia a la producción artesanal que se lleva a cabo en la mayoría de las pulcatas (Sitios de elaboración del pulque) de la República Mexicana. Esto determina que algunos de los procesos no estén estandarizados y no cumplan con las buenas prácticas de manufactura que garanticen la calidad del producto final. Por esta razón se está trabajando en la caracterización y composición del aguamiel para estabilizar y estandarizar la bebida. Lo que permitirá a futuro crear una Norma Oficial Mexicana (NOM) que documente un protocolo de elaboración más apropiado y de esta forma se aprovecharía mejor las propiedades nutricionales y probióticas que el pulque tiene.
Por otro lado los microorganismos con efecto probiótico se pueden aislar y recuperar para desarrollar inoculantes benéficos que serían reinoculados en otros productos derivados de la misma industria como mieles, bebidas ácidas, jarabes, jugos de frutas de sabor agradable y alto valor nutricional (24).
De acuerdo con Escalente, en el pulque se dan tres tipos de fermentación, ácida, alcohólica y viscosa. La interacción de las tres determina que se presente un incremento en los recuentos poblacionales, consumo de azúcares, proteínas, formación de etanol y algunos exopolisacáridos que le dan aspecto viscoso. De acuerdo a los grupos recuperados, las rutas metabólicas que se podrían estar llevando a cabo son Embden-Meyerhof y Entner-Doudoroff. Saccharomyces sp utilizó glucólisis para la obtención de carbono y energía. El piruvato como producto final de la ruta bioquímica se convirtió a etanol por la acción de la piruvato descarboxilasa y alcohol deshidrogenasa. Lactobacillus sp pudo utilizar la misma ruta para completar metabolismo energético y adicionalmente sintetizó exopolisacaridos que podrían ser b-glucanos y dextranos (23-25). Por el contrario
Zymomonas sp empleó la ruta de Entner Doudoroff a partir de la cual también se obtiene etanol (26).
Finalmente al realizar una comparación entre la cuantificación de etanol por un método tradicional como la cromatografía de gases y espectroscopia Raman se obtuvieron valores muy similares, sin embargo, se resalta las ventajas que podría tener la segunda técnica. A partir de diferentes muestras de pulque obtenidas de un proceso artesanal en el estado de Tlaxcala, México, se recuperó e identificó un consorcio microbiano formado por Saccharomyces sp, Lactobacillus sp y Zymomonas sp, el cual es responsable de la fermentación ácida, alcohólica y viscosa del pulque.
El producto obtenido tras 48 horas de fermentación a temperatura ambiente se caracterizó por tener 10.35 % (v/v) de etanol, 4.75 g/L de azúcares reductores y 1g/L de proteína. Con espectroscopia Raman se obtuvieron porcentajes de etanol muy similares a los obtenidos mediante cromatografía de gases, resultando ser un método directo y confiable para la cuantificación de la concentración de etanol en el pulque, en sus diferentes etapas de fermentación. Los tres grupos microbianos podrían tener un efecto probiótico.