María Alejandra León-Clavijo1, Edith C Hernandez-Rojas2
1Bacterióloga- Universidad Colegio Mayor de Cundinamarca
2Docente, Investigador Grupo EZCA- Programa de Bacteriología, Facultad de Ciencias de la Salud, Universidad Colegio Mayor de Cundinamarca.
Correspondencia: editherr@hotmail.com
Recibido: 05-04-2012 Aceptado: 02-06-2012
Por esto, el presente artículo de revisión profundiza y consolida la información existente sobre la infestación por garrapatas en bovinos, su impacto a nivel económico y sanitario, los métodos empleados para contrarrestarla, enfatizando en el control inmunológico; con el propósito de dar una idea clara y actualizada de esta problemática, resaltando además las opciones inmunológicas en el mercado y analizando el porqué y cuál de estas puede ser la mejor elección para el control de esta infestación que acarrea tantos problemas económicos en el mercado al que pertenece.
Palabras clave: Bm86, garrapatas, vacunas, bovinos, control garrapatas
Bm86 protein description, polymorphism and its role as an immunogen in cattle infested with ticks
In the area of tropical public health, the ticks are considered a problem that affects different sectors related to cattle production. Additionally ticks are considered one of the main vectors of infectious diseases, causing a significant economic impact especially in the dairy and meats. The present review goes in depth and consolidates existing data on tick infestations in cattle.
Their economic and sanitary impact, the methods used to counteract it emphasizing on the immunological control. in order to give a clear and update idea regarding this issue, highlighting the immunological options on the market and analyzing why and how these may be the best choice for controlling this infestation that brings many economic problems to the market to which it belongs.
Keywords: Bm86, tick, vaccines, bovine, control ticks.
Actualmente, la especie más afectada por estos artrópodos es el ganado bovino, en los cuales generalmente se presentan infestaciones masivas que generan deficiencias en la alimentación del animal y daño directo en las pieles, lo cual provoca grandes detrimentos económicos al productor (1,2). Además, se presenta anemia grave y abortos, ocasionados principalmente por la transmisión de Anaplasma marginale, Babesia bigemina y Babesia bovis (2-5), agentes patógenos de gran importancia para la salud pública. Durante años se ha intentado controlar las infestaciones de garrapatas mediante la implementación de acaricidas, pero su uso indiscriminado y una inadecuada asesoría, ha traído como consecuencia el surgimiento de cepas resistentes (6), que unido al impacto ambiental negativo que tienen, han llevado a que se desarrollen nuevos métodos de control, entre ellos el más promisorio es la utilización de imunógenos que inducen una respuesta capaz de disminuir la población de garrapatas (7).
Entre estos imunógenos encontramos que se destacan aquellos que han sido aislados de la garrapata Rhipicephalus (Boophilus) microplus como las proteínas Bm95 (8), Bm91 (9), QU13 (10, 11), vitelogenina (12) y el más conocido Bm86 (13).
Los Ixódidos comprenden unas 700 especies en 12 géneros: Boophilus, Rhipicephalus, Dermacentor, Amblyoma, Hyalomina, Haemaphysalis, Ixodes, Anocentor, Margaropus, Aponomina y Rhipicentor (20, 21); son cosmopolitas (15), encontrándose presentes en todas las latitudes, pero especialmente en climas tropicales y subtropicales (2), la mayoría de las especies son vectores de microorganismos causantes de patologías de gran prevalencia e incidencia en diferentes geografías y a gran variedad de vertebrados.
En cuanto a la familia Argasidae, también llamadas garrapatas de cuerpo blando (20, 22), estas se caracterizan por vivir bajo condiciones secas en los climas húmedos, escondiéndose en hendiduras (23), se alimentan de forma intermitente y muy rápidamente, además pueden permanecer mucho tiempo sin ingerir alimento (24). Comprende cinco géneros principales Otobius, Ornithodorus, Argas, Antricola y Nothoaspis (25).
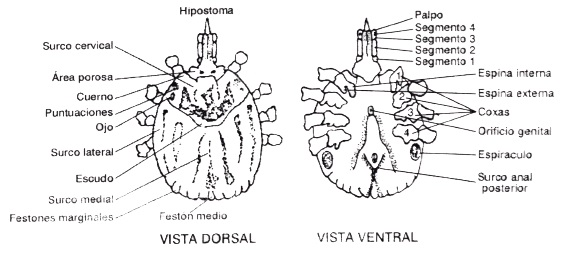
Respecto a la morfología de los Ixódidos, está caracterizada por presentar un cuerpo aplanado que mide entre 1 a 10 mm, Figura 1, alcanzando tamaños mayores cuando se ingurgitan de sangre (26) adquiriendo pesos superiores a 250mg (27).
La cabeza o capitulo está compuesto por una sustancia quitinosa que le permite a la garrapata proteger su sistema nervioso (15), esta presenta un par de quelíceros, órganos que están adaptados al parasitismo (28), puesto que son capaces de rasgar la piel del hospedero (15) para permitir la introducción de hipostoma, estructura dentada, grande y encargada de la succión. A lado y lado de este se encuentran los palpos que cumplen tres funciones principales, la primera tiene que ver con la detección de la zona apropiada para alimentarse (mayor irrigación de sangre y menor calibre del tegumento) (15), la segunda consiste en mantener sujeto e inmóvil el hipostoma durante la alimentación (28), y por ultimo son órganos protectores de la pieza bucal (hipostoma).
El cuerpo de estas garrapatas posee un escudo que cubre toda la superficie dorsal del macho (29), es decir es completo, mientras que en las hembras este es incompleto, solo llega a cubrir el tercio anterior, permitiendo así que el abdomen crezca y se agrande lo suficiente para contener hasta dos centímetros cúbicos de sangre (14-15).
Poseen ocho patas dispuestas en cuatro pares simétricos ente sí, excepto las formas larvarias que presentan seis (28), cada una de estas extremidades se encuentra formada por una serie de secciones articuladas: coxa, trocánter, fémur, tibia, protarso, tarso y un par de uñas (14).

Figura 1. Morfología general de una garrapata. Se muestran las partes que componen la estructura de la garrapata vistas tanto dorsal como ventralmente (14).
Ventralmente se puede observar el orificio genital, situado en la línea media del cuerpo de la garrapata más o menos a la altura del segundo par de patas y es el que le da la diferenciación sexual (14-15). La garrapata en su estado ninfal carece de orificio genital, y es posible observar en todas las fases de vida un orificio anal (20).
El cuerpo de las hembras grávidas presenta surcos marginales dispuestos lateralmente después del escudo. La zona posterior del cuerpo suele estar interrumpida, formando los denominados festones, en número variable pero suelen ser once (28). Estas dos estructuras le permiten a la hembra distender su abdomen durante la alimentación sin ninguna complicación.
En general, en cuanto a la morfología interna de las garrapatas de las familias antes mencionadas, estas se encuentran provistas de estructuras rudimentarias que garantizan su supervivencia, entre ellas encontramos un aparato circulatorio de tipo abierto muy simple (30). Su sistema digestivo básico consta de un aparato bucal, seguido por una faringe y esófago (14) que dan continuidad al estómago el cual presenta varios divertículos o ciegos gástricos (31). En estas estructuras la sangre es desdoblada a sustancias básicas que serán absorbidas por osmosis y pasaran a la cavidad general del cuerpo (celoma) para diluirse en la hemolinfa (14).
Las sustancias que no son absorbidas pasan a la porción terminal del intestino a través de unos canales excretores que convergen en un ano y orificio anal (31), por el cual van a ser secretados los desechos.
El sistema respiratorio está formado por tráqueas ramificadas, que se comunican al exterior por medida de espiráculos o estigmas respiratorios (32), su función es el intercambio gaseoso (30). Poseen una masa compacta de tejido nervioso dividido en dos, una porción dorsal de la cual salen los nervios que irrigan las piezas bucales y una parte ventral de la que salen nervios que se distribuyen a lo largo del cuerpo (31).
Ciclo de vida
Las garrapatas durante su vida, pasan a través de cuatro fases: huevos, larvas, ninfas y adultos (14). Los tres últimos estadios se caracterizan por ser estados activos del ciclo, en los cuales estos ectoparásitos se alimentan de sangre una vez en cada una de las fases, pudiendo permanecer durante mucho tiempo en los pastos (24).
El ciclo de vida de una garrapata se divide en tres etapas, Figura 2, la primera denominada no parasitaria o de vida libre comprende desde que la garrapata hembra repleta (teleogina) se desprende de su hospedero, hasta la aparición de las larvas en la vegetación (2). En esta etapa ocurre la ovoposición de los huevos alrededor de 3000 (33), la incubación y, eclosión de estos; lo cual dura entre 30 a 33 días generalmente, pero se debe tener en cuenta que la duración de esta fase depende directamente de las condiciones ambientales, cantidad de sangre digerida y la especie (15-33).
La segunda fase se conoce como fase de encuentro, en la cual las larvas pasan de la vegetación al hospedero (2), este es hallado gracias a quimiorreceptores que detectan diferentes gases, entre ellos el dióxido de carbono, amoniaco, ácido láctico, entre otros olores corporales (34).
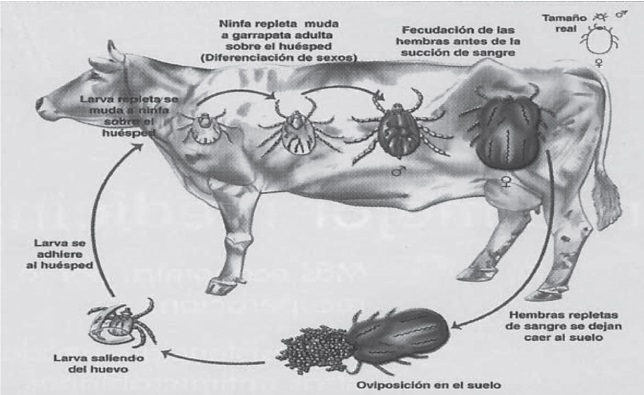
Figura 2. Ciclo biológico de la garrapata. Se muestra específicamente el ciclo biológico de la garrapata
Rhipicephalus (Boophilus) microplus, incluyendo los estadios dentro del hospedero y fuera del mismo (2).
Por último está la fase parasitaria en donde las larvas se alimentan intermitentemente de su huésped (15) hasta ingerir una buena cantidad de sangre y fluidos de los tejidos para mudar a ninfas (14), que seguirán alimentándose y realizan nuevamente una transformación, esta vez en machos y hembras jóvenes (33) que buscaran un nuevo hospedero para realizar la copula (28) y seguir alimentándose de sangre, asegurando así el origen de otra generación de garrapatas.
Reproducción de las garrapatas
Después de que ha alcanzado el estado de adulto, la hembra empieza a emitir una o varias feromonas que atraen al macho para llevar a cabo el apareamiento, esencial para que las hembras se repleten de sangre (34). Cuando el macho esta cerca busca el orificio genital de la hembra y extiende con sus piezas bucales la bulba (15), puesto que carece de órgano copulador, para posteriormente aplicar sobre este su espermatóforo directamente y fecundarla (28). El cigoto generado tiene un número diploide de cromosomas (15).
Más de un 90% de los ciclos de vida transcurre en el hospedero, puesto que las hembras y lo machos requieren de una alimentación de sangre para estimular la oogénesis y la espermatogénesis (35).
Se ha descrito además que los aspectos climáticos afectan pocoel desenvolvimiento de la garrapata adulta, ya que el microclima ofrecido por el hospedero las protege de las condiciones medioambientales (2).
Es por esto que se afirma que la fase parásita es poco variable, observándose hembras repletas generalmente a los 21 días, aunque estas se pueden observar desde el día 19 posterior a la infestación, mientras que entre 22 a 26 días, es el período en que se desprenden el mayor número de hembras repletas (35).
Hospedantes de la garrapata
Existen garrapatas que realizan su ciclo de vida en diferentes hospedadores, por lo que se les ha clasificado de acuerdo al número de estos que necesiten para completar su ciclo.
• De un solo huésped: comprende las garrapatas que pasan desde el estado de larva al de adultos sin cambiar de huésped, abandonándolo solamente cuando están llenas de sangre para ovopositar en el suelo (14).
• De dos huéspedes: son aquellas en las cuales sus larvas y ninfas se desarrollan en un vertebrado y los adultos en otro (33).
• De tres huéspedes: estas garrapatas se caracterizan porque siendo larvas, parasitan a un huésped al que abandonan después de alimentarse de su sangre, se dejan caer al suelo, donde mudan a ninfas, y suben a parasitar a un segundo huésped, que es nuevamente abandonado y ya en el suelo se transforman en adultos y vuelven a un tercer huésped (14).
Las garrapatas de dos y tres huéspedes pueden trasmitir microorganismos patógenos entre las fases; es decir, una infección adquirida por una larva de garrapata se conserva a través de la muda a la fase de ninfa y después se trasmite al hospedador del que se alimenta la ninfa; o bien de ninfa a adulto (29).
Importancia global de las garrapatas
Globalmente, la salud y el bienestar animal y humano han estado sujetos a las continuas infestaciones por ectoparásitos (36), entre estos las garrapatas de la familia Ixodidae, son los que demandan mayor importancia a nivel médico veterinario, puesto que se les considera los principales vectores de enfermedades infecciosas en el mundo industrializado, superando en este papel a mosquitos, pulgas y piojos (37). Además las pérdidas económicas que causan a los sistemas productivos pecuarios, son elevadas.
Importancia en salud animal
En la actualidad uno de los principales problemas en salud animal que se presenta en las regiones tropicales y subtropicales es la infestación por garrapatas (38- 40) y, en particular, la infestación por R.microplus (36), garrapata que afecta a gran escala las explotaciones ganaderas de América latina, especialmente los países ubicados entre los paralelos 32º de latitud sur y 32º de latitud norte, entre los que se encuentra Colombia (41).
Se sabe que los daños ocasionados por la presencia de garrapatas son directos, al ejercer una acción traumática, toxica, infecciosa y exfoliatriz; e indirectos, representados por el deterioro de la piel, disminución de la producción de carne y leche, crecimiento retardado de los animales y dificultades en la aclimatación de razas seleccionadas (42), además de los daños medioambientales y de los sobrecostos que trae su subsiguiente control.
Las pérdidas directas ocasionadas por la presencia de garrapatas están condicionadas por su parasitismo estricto (39).
Independientemente de su importancia como agentes vectores de enfermedades graves para el hombre y los animales, las garrapatas son importantes por sí mismas como parásitos (28), gracias a su gran capacidad reproductora y a la facilidad de infestar a un animal y posteriormente a toda la manada, tanto así, que se ha estimado que el ganado de regiones tropicales de Australia puede ser infestado con 1000 larvas de garrapatas por día (43).
Se debe tener en cuenta que las garrapatas a partir de sus estados más inferiores, es decir desde larvas hasta que son adultas, se alimentan de sangre y en algunas especies de linfa, lo cual indica que una infestación de larvas, ninfas y/o garrapatas adultas representara una disminución significativa en la sangre del bovino.
Se sabe que una hembra puede llegar a extraer 3 centímetros cúbicos de sangre bovina (4), que si son trasmitidos durante la alimentación si de estos artrópodos sobre animales susceptibles (2, 5, 14, 43, 44), se presentara una anemia progresiva, que de no ser controlada y tratada traerá como consecuencia retraso en el crecimiento, engorde y posteriormente puede fácilmente conducirlo a la muerte.
Es importante resaltar que al momento de alimentarse, la garrapata inyecta saliva y algunas sustancias tóxicas a la sangre del animal (3), entre estas toxinas se encuentra la holociclotoxina, que está en abundantes cantidades en las hembras grávidas y puede estar aún más concentrada en garrapatas que han permanecido en un ayuno prolongado; los machos la segregan en menor cantidad y concentración (28).
La acción de la holociclotoxina se centra en las sinapsis neuromusculares, bloqueando la acetilcolina, y por ende, sus efectos a nivel de la contracción muscular (28). Las manifestación clínica principal que se presenta es una parálisis flácida aguda (3) acompañada de alteraciones en la marcha, trastornos en la visión y síndromes atáxicos que son resultado de una depresión neuronal central (28).
Se cree además, que esta proteína actúa favoreciendo la vasodilatación y evitando que se presente la coagulación, lo cual facilita la succión de sangre y disminuye la velocidad de cicatrización (3, 28), permitiendo de esta manera que las heridas causadas por las picaduras de garrapatas sean un problema, puesto que cuando están abiertas, se pueden formar gusaneras dado que atraen a las moscas que producen miasis (4), lo que significa una disminución significativa en la calidad de la piel del bovino y por ende una disminución en la producción de cuero en la industria curtiembre, con sus consecuentes pérdidas económicas.
Otro factor a tener en cuenta en las infestaciones masivas es el estrés generado en el animal que se manifiesta con nerviosismos, irritación, prurito constante y descenso en la alimentación lo que conllevara a baja producción láctea (4, 28).
Dentro de los daños indirectos el que cobra mayor importancia es la transmisión de microorganismos patógenos, entre los que podemos destacar los protozoos pertenecientes a los géneros Babesia y de la rickettsia Anaplasma marginale (45, 46) causantes de ranilla roja o babesiosis, Figura 3, y de ranilla blanca o anaplasmosis, Figura 4 (14).
La babesiosis o fiebre de garrapatas, es una enfermedad febril de animales domésticos y salvajes caracterizada por una amplia lisis de eritrocitos, presentando como consecuencia anemia, ictericia y hemoglobinuria, llegando a ser fatal (47).
La anaplasmosis bovina es una infección no contagiosa, caracterizada en la forma aguda por anemia, debilidad, constipación, mucosas de color amarillo, disminución del apetito, depresión, deshidratación y respiración dificultosa (46).
Los animales que sobreviven presentan una recuperación lenta, lo que se traduce en pérdidas económicas, puesto que se disminuye la producción de leche y carne en la explotación.
Importancia económica
De forma global, se estima que el 80% del ganado bovino del mundo está infestado con garrapatas, y esto provoca pérdidas de 2.000 a 3.000 millones de dólares. De hecho, hay regiones del mundo donde la industria ganadera no ha podido establecerse debido al problema de las garrapatas y las enfermedades asociadas (7).
En muchos países se han valorado las pérdidas económicas ocasionadas por las garrapatas al ganado vacuno. En un estudio realizado en 1972 se señaló una relación entre la reducción de la ganancia de peso y el total de garrapatas, concluyendo que se produce una pérdida de 0.28Kg por cada garrapata, promedio/año/vacuno.
En otro estudio realizado por Springell, (1974), se dedujo que la ingurgitación de una R.microplus, causa la pérdida de 450 gramos de peso de un bovino al año (49).

Figura 3. Evidencia celular de infección con garrapatas. Se observa a nivel microscópico glóbulos rojos bovinos parasitados con Babesia bigemina y Babesia bovis a causa de infestación con garrapatas; en purpura se observan las pequeñas y grandes formas de Babesia en el citoplasma del eritrocito (42).
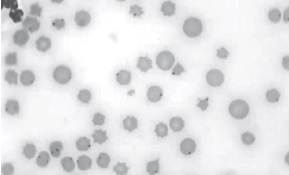
Figura 4. Infección celular ocasionada por garrapatas. Se observa a nivel microscópico glóbulos rojos bovinos parasitados con Anaplasma marginale a causa de infestación con garrapatas; en violeta la rickettsia dentro del eritrocito bovino (48).
Las pérdidas económicas causadas por la infestación de garrapatas son cuantiosas, la FAO estimó que las pérdidas ocasionadas por estos artrópodos y los microorganismos trasmitidos por su picadura a nivel mundial sobrepasan los 7.000 millones de dólares (50), en otros estudios realizados en Australia en 1990 indicaban que las pérdidas anuales alcanzaban los 5 dólares por cabeza de ganado (47), en un estudio más reciente, realizado en el año 2002, se indica que las pérdidas por cabeza de animal alcanzan los 7 dólares (51), lo que demuestra que las mermas económicas provocadas por la infestación de garrapatas están en aumento y que los planes de control implementados han fracasado.
Siendo más concretos, Brasil es el quinto país con más cabezas de ganado en el mundo y las pérdidas económicas se ha estimado que llegan a los 800 millones de dólares, por daños directos e indirectos causados por la infestación de R.microplus (51).
El control de las garrapatas ha sido una práctica común dentro del manejo rutinario del ganado (1), puesto que las infestaciones por las garrapatas son bastantes comunes y es necesario mantenerlas al margen de explotaciones ganaderas.
En respuesta, a esto se han creado diversas estrategias que se pueden agrupar en tres categorías, dependiendo de la naturaleza de su acción: control biológico, control químico (51) y control inmunológico.
Control Biológico
El control biológico constituye hoy una de las alternativas promisorias para el control integrado de garrapatas (24). Dentro de este grupo se encuentran estrategias relacionadas con la resistencia propia de los bovinos, la modificación del hábitat de las garrapatas (1) y la implementación de reguladores biológicos (24).
La implementación de razas resistentes a las garrapatas es un método de control que se basa en la resistencia innata y evolutiva que presentan las razas Bos indicus frente a las Bos taurus a la infestación por garrapatas (1), rasgo que presenta un mayor porcentaje de heredabilidad en las primeras (52) y en donde la inmunidad adquirida durante los primeros años de vida juega un papel importante (53).
Las actividades de modificación del hábitat buscan afectar de manera negativa el desarrollo de la garrapata en su fase no parasitaria, implica prácticas como rotación y descanso de potreros, quema controlada, inundación, remoción de maleza e inclusión de plantas que poseen acción contra las garrapatas (Stylosanthes spp, Gynandropsis ginandra, Azadirachta indica) (1), aunque la aplicación de esta última a nivel de ganaderías y establos aún es muy nulo y se espera que pronto sea determinado (54).
La implementación de métodos que buscan modificar el hábitat requiere de un manejo sistemático, planificado y técnicamente dirigido, de manera que sean económica y ambientalmente viables.
Los reguladores biológicos son organismos depredadores de las garrapatas, que atacan a estas en sus diferentes fases, y ofrecen como resultado una acción reductora.
Entre estos se encuentran algunas especies de hormigas (Pheydole spp.), arañas (Lycosa spp.), hongos (Beauveria bassiana, Metarhizium anisopliae), bacterias, protozoos, virus, aves (garzas), escarabajos, avispas y nematodos entre otros (1).
El uso de hongos entomopatógenos como alternativa de control biológico no representa riesgo de contaminación ambiental y no produce efectos residuales (55). Es importante tener claro que la susceptibilidad de las garrapatas a los hongos entomopatogénicos varía para las diferentes especies y cepas, tanto de hongos como de garrapatas (56).
Actualmente a nivel de laboratorio se está trabajando con bacterias como Cedecea lapagei y los resultados son alentadores (57).
Control químico
Ha sido hasta el momento el arma principal utilizada y en la gran mayoría de los casos la única para controlar las garrapatas (7), puesto que presenta como ventajas: visualización de un efecto inmediato, relativa simplicidad en la aplicación, larga duración, economía, entre otras (58, 59).
La mayoría de los acaricidas utilizados en el control de garrapatas, son insecticidas de contacto, es decir que penetran a través de los espiráculos del insecto, solubilizándose y llegando rápidamente a los quimiorreceptores de los órganos nerviosos, originando parálisis y la muerte (60-61).
Se debe tener en cuenta que al realizar un control químico de las garrapatas, el éxito de este no dependará solamente de la actividad del producto, sino que factores como la periodicidad del baño, calidad y cantidad de ingrediente activo (3),que juegan un rol importante en la efectividad del tratamiento.
A pesar de las ventajas y éxito parcial que se obtiene con la aplicación de este método de control, los inconvenientes implícitos son mayores, dentro de estos se pueden mencionar, el impacto negativo sobre el ambiente, residuos en los productos derivados del ganado, alto costo y surgimiento de cepas resistentes (38, 43, 51, 62, 63).
Resistencia al control químico (acaricidas)
Dentro de las desventajas que tiene el uso de acaricidas en el control de garrapatas, la que representa un mayor problema es el surgimiento de cepas resistentes a estos químicos (59, 64, 65), que se da generalmente por el uso extensivo y de manera inescrupulosa de los acaricidas (66). Esto genera un proceso largo y costoso que implica la investigación y generación de nuevas moléculas acaricidas (3).
La Organización Mundial de la Salud (OMS) definió el fenómeno de resistencia como la capacidad adquirida por individuos de una población parásita que les permite sobrevivir a dosis de químicos que generalmente son letales para una población normal (67, 68) de la misma especie y es el resultado de la presión de selección positiva ejercida por el acaricida sobre genes inicialmente en baja frecuencia (54).
El desarrollo de resistencia por parte de las garrapatas es un proceso evolutivo que involucra diversos factores genéticos (63, 67, 69-71), como la frecuencia y numero de alelos resistentes, la dominancia, penetración, expresividad e interacción que tengan estos (63); biológicos, como el numero de generaciones y de descendientes por generación; y relacionados con los químicos, dentro de los que cabe señalar la naturaleza, el uso, umbral de aplicación y frecuencia de tratamientos (67, 70-72).
La resistencia se da cuando las mutaciones que ocurren de manera natural, le permiten a una pequeña proporción de la población (alrededor de uno en un millón de individuos) resistir y sobrevivir a los efectos de los productos químicos empleados como pesticidas (73).
Antes de la aplicación de un ixodicida a una población de garrapatas, los individuos con alelos que confieren resistencia son escasos, por lo tanto, la mayoría de individuos son susceptibles, por ende muren por efecto del toxico, y solo quedan vivos los resistentes, que se reproducen y trasmiten a sus progenies los genes de resistencia, conformando así nuevas poblaciones de garrapatas resistentes al acaricida (74).
Las fases que presenta el desarrollo resistencia son tres, la primera se denomina “de establecimiento” y hace referencia a un mecanismo pre adaptativo, en esta fase no se perciben cambios en el comportamiento o fisiología en la garrapata.
La siguiente es la fase de dispersión, en la cual hay supervivencia preferencial de algunos individuos resistentes a tratamientos de acaricidas, presentándose una predominancia en el proceso de selección genética. Por último está la fase de emergencia, en donde la resistencia es lo suficientemente común para reducir la efectividad del tratamiento (67, 75).
Una vez se ha presentado la resistencia en una población de garrapatas, no hay nada que se pueda hacer para volver a las garrapatas a su estado original de susceptibilidad, el único recurso posible es emplear otro ixodicida, que se encargue de destruir las garrapatas resistentes (76).
Control inmunológico
En la necesidad por encontrar nuevas opciones y alternativas de lucha que eliminen el carácter tóxico de las formas tradicionales y permitan un uso racional de los acaricidas químicos para lograr menos daños directos y colaterales a la producción y el medio ambiente, se han desarrollado nuevas estrategias (77, 78), de las cuales la que ha tomado mayor importancia es el control inmunológico, puesto que este busca generar una respuesta inmunológica que sea capaz de mantener al margen a las garrapatas.
Esta vía tiene como perspectiva una protección de mayor duración y está exenta de problemas de índole ambiental, a diferencia del tratamiento con acaricidas químicos (13), aunque actualmente un manejo integrado de garrapatas incluye el uso de vacunas con baños acaricidas (79).
Relación inmunológica hospedero – huésped
Las bases históricas de este control están en la naturaleza, puesto que durante la infestación con garrapatas se establece una relación muy estrecha con el hospedero bovino (34, 78), dando como resultado la estimulación del sistema inmune del animal.
Desde este punto de vista, las garrapatas poseen varias sustancias, entre ellas las secreciones orales, que al ingresar al hospedero serán reconocidas como unas moléculas extrañas y de inmediato se iniciará la producción de biomoléculas y células que actúen en contra de ellas (80-83).
Las exposiciones repetidas o continuas provocan que las garrapatas que se alimentan del hospedero entren en contacto con los elementos de la repuesta inmune primaria. Por lo tanto, los inmunógenos salivales estimulan la respuesta de memoria de linfocitos T y B, los cuales garantizan una respuesta inmune potente después de la reinfestación con garrapatas, Figura 5 (13).
Se debe tener en cuenta que esta respuesta depende de la especie de garrapata y hospedero, las variaciones que presenten son factores determinantes para asegurar el control de la infestación (85). Además se ha observado que algunos hospederos no son capaces de contrarrestar la infestación a través de la inmunidad natural adquirida, esto se debe principalmente a los compuestos salivales de algunas especies de garrapatas, que poseen la habilidad de suprimir o eludir los mecanismos de defensa del animal (51, 83, 85), por lo tanto se concluye que estos compuestos son de gran importancia para la supervivencia de la garrapata pues modulan la respuesta inmune innata y adquirida (83).
Control inmunológico con vacunación
Los conocimientos expuestos anteriormente y algunos estudios realizados han comprobado que hay una respuesta humoral y celular después de la infestación de garrapatas pertenecientes a géneros como
Amblyomma, Dermancentor y Rhipicephalus (34, 87, 88), por lo cual se han realizado vacunas basadas en esta reacción natural, ya sea por medio de la inoculación de extractos de tejidos, antígenos salivales o antígenos de tipo oculto, entre otros. (34)
Las ventajas de utilizar las vacunas como método de control frente a la infestación por garrapatas, incluyen una acción sostenida, estar libres de residuos, ser intrínsecamente específicas, mayor economía frente al manejo químico y probabilidad de desarrollo de resistencia nula (89, 90), sin embargo el éxito de este método depende de la identificación, clonación y expresión in vitro de las moléculas claves en las funciones fisiológicas de la garrapata (91).
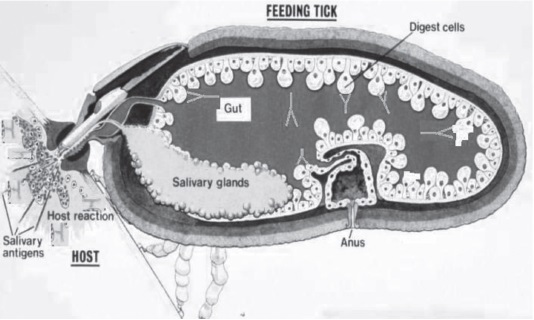
Figura 5. Detalles del proceso de infestación por garrapata. Se observa la interacción hospedero- garrapata, donde se evidencia el contacto entre el hipostoma del artrópodo inoculando sustancias propias de su aparato bucal simultáneamente a la succión de sangre del huésped (84).
Los antígenos utilizados para la elaboración de vacunas contra garrapatas, se pueden clasificar en dos grupos, el primero de estos incluye los involucrados en la resistencia adquirida de forma natural a la infestación, es decir, los inmunógenos expuestos en gran cantidad por los procesos normales de fijación de garrapatas y de alimentación (13, 92).
El segundo grupo son los denominados antígenos ocultos, estos hacen referencia a aquellos que permanecen de forma natural ocultos al sistema inmune del animal, es decir que no juegan ningún papel en la interacción hospedero-parásito (93).
Los primeros poseen un inconveniente ya que normalmente coevolucionan con las garrapatas, por lo que se desarrolla una adaptación durante la interacción hospedero- parásito, generando una protección parcial (3). En cambio, los segundos poseen una gran ventaja, evitar los mecanismos de evasión parasitaria, es decir que gracias a la falta de contacto entre los antígenos ocultos y el sistema inmunológico, la garrapata no puede desarrollar una estrategia para escapar a la acción de la repuesta inmune del animal (13, 94).
Sin embargo, se debe tener en cuenta que es necesario realizar varias inmunizaciones de refuerzo para mantener una concentración efectiva de anticuerpos (94).
Varios antígenos ocultos han sido aislados como candidatos vacúnales, entre ellos vale destacar los extraídos a partir de la garrapata Rhipicephalus (Boophilus) microplus como lo son el Bm95 (8), Bm91 (9), vitelogenina (12) y el más conocido, Bm86 (13).
Este último ha demostrado en diversos estudios que induce una respuesta inmune protectora frente a infestaciones por Rhipicephalus (Boophilus) microplus en bovinos inmunizados (43, 95, 96).
Bm91: Es una glicoproteína que se encuentra en las glándulas salivales y en el intestino medio de R.microplus (97), se considera una carboxipeptidasa, que comparte muchas propiedades enzimáticas y bioquímias con la enzima convertidora de angiotensina testicular (ACE) en mamíferos (5, 9, 98), Este inmunogéno ha sido expresado como una proteína recombinante en E.coli (99). Su eficacia no supera los resultados obtenidos con Bm86, pero en combinación con este se potencializa su efecto (98, 100).
Bm95:Esta proteína ha sido aislada de células intestinales de R.microplus cepa A de Argentina (101), en 1999 fue secuenciada y se encontró que solo difería de la proteína Bm86 en 21 aa (102). El antígeno fue ensayado en bovinos en condiciones de producción y se demostró que es efectivo contra diferentes cepas de garrapatas (103-104).
Vitelogenina: Es una proteína sintetizada en los ovarios, cuerpos grasos e intestinos de los artrópodos, es precursor de la vitelina, la cual sirve de alimento a embriones y larvas (12, 105). En el 2002 (101) se demostró que tenía una efectividad del 66% en ovinos, aunque en bovinos no ha sido evaluada (12).
Bm86: Ha sido postulada como el mejor inmunógeno frente al control de la garrapata R.microplus, es una glicoproteína que fue aislada por Willadsen y colaboradores en 1989 (106) a partir de las células de las microvellosidades del intestino de la garrapata R.microplus cepa Yeerongpilly (107 - 109).
El antígeno Bm86 hace parte de la familia de proteínas Bm86, junto con proteínas propias de otras garrapatas Ixodes y Argasidae como Hyaloma marginatum marginatum (Hm86), Amblyomma variegatum (Av86), Dermacentor reticulatus (Dr86), Haemophysalis longicornis (HI86), Hyalomma anatolicum (Haa86), Ixodes ricinus (Ir86-1), Ixodes scapularis (Is86-2), Ornithodoros savignyi (Os86), Figura 6, poseen como característica principal tener una gran cantidad de residuos de de cisteínas y contener varias dominios con similitud al factor de crecimiento epidermal (108).
Esta proteína tiene un peso molecular de 890.000 Da, está conformada por 650 aa que son traducidos a partir de 2225 pb , Figura 7, (22, 81), se presume que es muy plegada (82, 75), actualmente se le relaciona con el proceso de endocitosis (83).
Se ha determinado que la proteína madura posee una región hidrofobica que abarca 23 aa de la porción carboxilo-terminal ubicada en la región transmembranal, por lo cual se deduce que está implicada en la unión de la proteína a la membrana celular; a excepción de esta región carboxilo-terminal, Figura 8, la proteína presenta un alto potencial hidrofílico (107, 114).
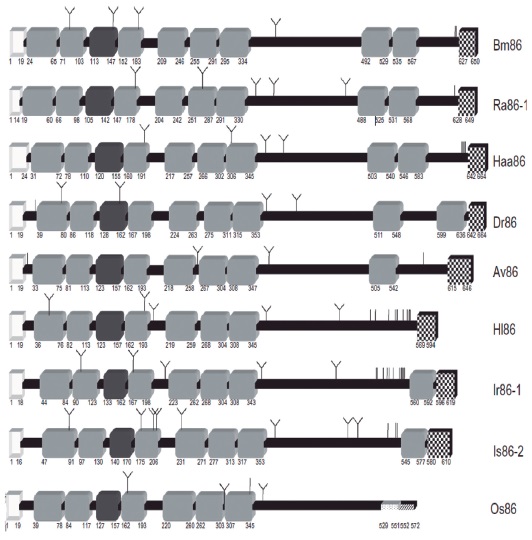
Figura 6. Comparación entre las estructuras de las proteínas pertenecientes a la familia de proteínas Bm86. Se muestran los péptidos señal (cajas blancas), los dominios similares al EGF (cajas gris oscuro), el anclajeglicosilfosfatidilinositol (GPI) (cajas a cuadros), dominios trasmembranales (rectángulo punteado), dominiosintracelulares (rectángulo rayado), los O- carbohidratos de potencial vinculación (líneas verticales) y losN- carbohidratos (con el símbolo Y) (108).

Figura 7. Secuencia de ADN y aminoácidos derivados de Bm86 (27).
El gen Bm86 ha sido clonado y expresado en forma de cuerpos de inclusión en diferentes vectores, como Escherichia coli, baculovirus y Aspergillus spp; la respuesta inducida por estos cuerpos ha sido baja; posteriormente se expresó en la levadura Pichia pastoris dando resultados satisfactorios para controlar la infestación de garrapata R.microplus (85, 119).
Bm86 como vacuna
En la última década del siglo XX, los australianos y cubanos lanzaron al mercado vacunas que contenian el antígeno recombinante Bm86, estas vacunas TickGARDTM (Australiana) y Gavac® (Cubana) han sido ensayadas en pruebas de campo y de laboratorio mostrando una protección de aproximadamente 80% (115 - 117).
La protección expresada por la respuesta de anticuerpos que induce la vacunaciónse va a manifestar por una reducción en el número de garrapatas, el peso y la capacidad reproductiva (87,118), se ha demostrado que más del 90% de las garrapatas no puede sobrevivir, en animales inmunizados con tan solo 2ug de Bm86 en tres dosis (43).
Tick GARD TM: Consisten en la expresión del antígeno recombinante rBm86 en la bacteria E.coli, esta vacuna fue lanzada al mercado en 1994 y ha reportado una reducción total de infestación del 56% en bovinos vacunados (106).
Gavac ®: vacuna recombinante, basada en la producción de rBm86 en Pichia pastoris (110), en vehículo Montanide 888 y aceite mineral en una emulsión de agua (15, 115). Actualmente se sabe que reduce el uso de acaricidas en un 95%, además de disminuir en 10 veces el índice de hemoparásitos y muertes por estos (7). A partir del análisis de la proteína Bm86 y gracias a sus propiedades se han desarrollado péptidos sintéticos derivados de esta glicoproteína. Estos péptidos, se han usado como antígenos vacúnales en bovinos y han presentado una eficacia entre el 35% y el 81% (113), dentro de este grupo se destaca el antígeno sintético SBm7462, puesto que en los ensayos realizados ha mostrado buenos resultados (110).
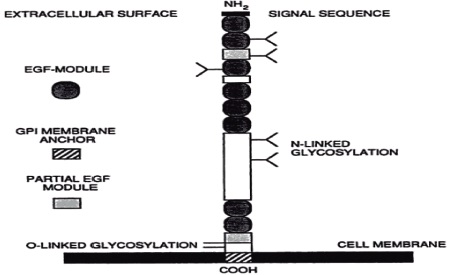
Figura 8. Estructura de la proteína Bm86. Se observa la arquitectura de la proteína anclada a membrana en las células de Rhipicephalus (Bophilus) micriplus (27, 107).
Polimorfísmo de la proteína Bm86
Un hecho interesante que ha mostrado la vacunación con el antígeno recombinante Bm86, es la variabilidad que presenta la eficacia de la respuesta inmune inducida por éste en diversas regiones y cepas de garrapatas.
Diversos autores han señalado que la vacunación con el antígeno rBm86 ha mostrado mayor eficacia en cepas de garrapatas heterólogas que contra R.microplus de la cual se derivó el inmunogéno (120).
Se ha determinado que la vacunación con el antígeno ha tenido un alto porcentaje de protección >99.97% frente a R.annulatus, 72 % en relación con en las especies de Hyalomma ssp. Y 70% en R.decoloratus (112,121) comparado con una eficacia de 85,2 % en R. microplus (112), lo que sugiere la presencia de polimorfísmos en el gen codificador de la proteína que conlleva variaciones en aminoácidos que conforman el inmunogéno (41, 110, 122).

Figura 9. Comparación de la secuencia de la proteina Bm86 (aminoácidos 539 - 573) de diferentes cepas de Rhipicephalus (Boophilus) microplus. Se indican las abreviaciones para las cepas de garrapata asi: Y, Yeerongpilly (Australiana y Cubana); C, Camcord (Cubana); YB, Ybm22M8 (Australiana); T, Tuxipan (Mexicana); M4, Mora (Mexicana); A, A (Argentina); AF1 (Argentina); AF2 (Argentina); Mex, MexBm86 (Mexicana); VB, VBm02 (Venezolana). Los astericos indican aminoácido conservado en dichas posiciones y la variación de los mismos se indica con el animoacido respectivo cambiante (123).
Se ha demostrado que variaciones superiores al 2.8% en la secuencia de aminoácidos son suficientes para que la vacuna con rBm86 sea ineficaz (41, 123). Además, se ha reportado que existen poblaciones de R.microplus que poseen un bajo potencial para desarrollar la respuesta inmune adecuada después de la inmunización con la proteína Bm86 recombinante (69, 123), lo que ratifica la implicación que tiene las variaciones de secuencias en el locus Bm86 (110) con la adecuada protección inmunológica que induzca la vacunación.
Recientemente se encontró en diferentes cepas suramericanas de R.microplus una variación de 1,76% hasta 3.65% en los nucleótidos del gen Bm86 (110), lo cual inevitablemente lleva a polimorfismos en la estructura completa de la proteína; resultados similares han sido reportados demostrándose una divergencia del 5.7% al 8.6% en cepas de Australia, México, Cuba y Argentina (123). En la Figura 9 se observan las variaciones en los aá 539 – 573 de la proteína, lo que permite deducir los polimorfísmos presentes en las cepas de diferentes regiones. Se escogió este fragmento porque se ha comprobado que la ubicación de la mutaciones es dispersa y no agrupados en epítopes como se creía (123).
La gran mayoría de autores explican estos resultados desde una perspectiva netamente geográfica, es decir que las variaciones genéticas presentes en las cepas se deben a las condiciones medio ambientales en las cuales han evolucionado las garrapatas (123, 124, 125, 126, 127, 128, 129), esta conclusión toma mayor relevancia con resultados reportados que demuestran que existe dos clanes de R.microplus, uno Australiano y el otro Americano (130), esto sustentado bajo pruebas de cruces homólogos y heterólogos entre cepas provenientes de las dos zonas, lo que siguiere que los linajes de R.microplus se separan tanto en aspectos biogeograficos como ecológicos (18).
La adaptación evolutiva desarrollada por las garrapatas, implicada en la eficacia de la vacunación requiere de la realización de investigaciones relacionadas con las condiciones ambientales, climáticas y del entorno en el que se desarrolla la interacción Hospederohuésped (131), los resultados arrojados por estos estudios permitiría alcanzar una mayor eficacia en la vacunación contra garrapatas (41).
Perspectivas
El presente artículo presenta y resalta el papel inmunogénico que posee la proteína Bm86, documentándose una eficacia del 91% frente a la cepa Camcordde R.microplus y el rol que juega su polimorfismoen el control inmunológicode las garrapatas que parasitan a los bovinos,destacándose que existen cepasen las que hay una variabilidad superioral 8% en los aminoácidos que conformanla proteína (cepas originarias de México,Argentina y Brasil) y la mayor eficacia quepresenta esta en especies de garrapatasdiferentes a R.microplus. Estos resultadosdemuestran que es necesario seguir realizandoinvestigaciones referentes al temaen cada región, para determinar los polimorfismospresentes en cada cepa y enbusca de nuevos inmunogénos que generenuna protección más eficaz y universal.
2. Rodríguez, R. Rosado, A. Basto, G. García, Z. Rosario, R. Fragoso, H. Manual técnico para el control de garrapatas en el ganado bovino. Centro Nacional de Investigación Disciplinaria en Parasitología Veterinaria. México. 2006. Publicación técnica N°4.
3. Rajput, Z. Hu, S. Chen, W. Arijo, A. Xiao, C. Importance of ticks and their chemical and immunological control in livestock. J Zhejiang Univ SCIENCE B, 2006; 7(11):912-921.
4. Florin-Christensen, M. Farber, M. Garrapata de los bovinos: una amenaza de ocho patas para el ganado del NOA. Salta productiva, 2008; 25: 1-6.
5. Nijhof, A. Taoufik, A. de la Fuente, J. Kocan, K. de Vries, E. Jongejan, F. Gene silencing of the tick protective antigens, Bm86, Bm91 and subolesin, in the one-host tick Boophilus microplus by RNA interference. Int J Parasitol, 2007; 37(6): 653–662.
6. Bravo, M. Coronado, A. Henriquez, H. Susceptibilidad de larvas y adultos de Boophilus microplus al ixodicida coumafos en explotaciones lecheras del estado Lara, Venezuela. Zootecnia Trop. 2008; 26 (1): 41 -46.
7. Suárez M, Méndez M, Valdez M, Moura R, Reis J, Vargas N, Ascanio E. Control de las infestaciones de la garrapata Boophilus microplus en la ganadería Cubana y en regiones de Latinoamérica con la aplicación del inmunógeno Gavac® dentro de un programa de lucha integral. [Monografía en internet], Colombia: RedEctopar; 2007[acceso 17 de septiembre de 2009] Disponible en: http://www.corpoica.org.co/Sit ioWeb/Archivos/Conferencias/Vacs1Cuba.pdf
8. García- García, J. Montero, C. Redondo, M. Vargas, M. Canales, M. Boue, O. Rodríguez, M y col. Isolation of Bm95 from the cattle tick Boophilus microplus a more universal antigen for the control of the infestations. Vaccine, 2000; 18 (21): 2275 – 2287.
9. Jarmey, J. Riding, G. Pearson, R. McKenna, R. Willadsen, P. Carboxydipeptidase from Boophilus microplus: a “concealed” antigen with similarity to angiotrnsin – converting enzyme. Insect Biochem Mol Biol, 1995; 25 (9): 969 – 974.
10. Lee, R. Opdebeeck, J. Isolation of protective antigens from the gut of Boophilus microplus using monoclonal antibodies. Immunology, 1991; 72: 121 – 126.
11. Lee, R. Jackson L. Opdebeeck, J. Immune responses of cattle to biochemical modified antigens from the midgut of the cattle B. microplus. Parasite Immunol, 1991; 13: 661 – 672.
12. Granjeno, C. Estrada, M. Mosqueda,J. Hernández, O. García, V. Variabilidad en la secuencia de un fragmento del gen de la vitelogenina de la garrapata del ganado Boophilus microplus. Disponible en: http://ammveb.net/XXX%20CNB/memorias%202006/parasitarias/carteles/rpar03.doc
13. Rodríguez, M. Respuesta inmunológica contra garrapatas. Biotecnología aplicada, 2000; 17: 215 -220.
14. Parra, M. Peláez, L. Segura, F. Arcos, J. Londoño, J. Diaz, E. Vanegas, M. Manejo integrado de garrapatas en bovinos. Publicación CORPOICA, 1999.
15. Gutiérrez, J. Identificación de órganos blanco en garrapatas de la especie Boophilus microplus para anticuerpos antigarrapata de bovinos inducidos por el inmunógeno Tick- Vac MK® del laboratorio Limor de Colombia S.A. mediante métodos de inmunoperoxidasa. [Pregrado]. Bogotá, D.C. Pontificia Universidad Javeriana, 2006.
16. De la Fuente, J. Kocan, K. Strategies for development of vaccines for control of ixodid tick species. Parasite Immunology, 2006; 28: 275 – 283.
17. Quiroz H. Parasitología y enfermedades parasitarias de animales domésticos. México: Editorial Limusa, S.A. 2005.
18. Nava, S. Guglielmone, A. Mangold, A. An overview of systematics and evolution of ticks. Front Biosci, 2009; 14: 2857 – 2877.
19. Marquéz, F. Hidalgo, A. Contreras, F. Rodríguez, J. Muniain, M. Las garrapatas (Acarina: Ixodida) como trasmisores y reservorios de microorganismos patógenos en España. Enferm Infecc Microbiol Clin 2005;23(2):94-102.
20. Guglielmone, A. Bechara, G. Szabó, M. Barros-Batesti, D. Faccini, J. Labruna, M. De la Vega, R. Garrapatas de importancia médica y veterinaria: América latina y el Caribe, 2003. Disponible en: http://www.cnog.com.mx/Sanidad/Garrapatas/Guia_Neotropical_Esp
21. Horak, I. Camicas, J. Keirans, J. The Argasidae, Ixodidae and Nattalliellidae (Acari: Ixodida): a world list of valid tick names. Experimental and Applied Acarology, 2002; 28: 27 -54.
22. Iannacone, J. Ayala, L. Censo de Ornithodoros amblus Chamberlin (Acarina: Argasidae) en la isla Mazorca, Lima, Perú. Parasitol Latinoam, 2004; 59: 56 – 60.
23. Iraola, V. Introduccion a los ácaros (I): Descripción general y principales grupos. Bol.S.E.A., 1998; 23: 13 – 19.
24. Márquez, D. Nuevas tendencias para el control de los parásitos de bovinos en Colombia. Una estrategia sostenible para el siglo XXI. Corpoica, 2003.
25. Gonzales, D. Estado actual del conocimiento de las garrapatas (Acari: Ixodoidea) en Chile. Ciencia ahora, 2005; 15.
26. Botero D, Restrepo M. Parasitosis humanas. 3ª ed. Colombia: Corporación para investigaciones biológicas; 1998.
27. Rand, K. Moore, T. Sriskantha, A. Spring, K. Tellam, R. Willadsen, P. Cobon, G. Cloning and expression of a protective antigen from the cattle tick Boophilus microplus. Proc. Natl. Acad. Sci. USA, 1989; 86: 9657 – 9661.
28. Jeremias, X. Ixódidos y argásidos en dermatología y medicina infecciosa. Garrapatas de importancias médica y sanitaria. [Monografía en internet], Barcelona: Universidad autónoma de Barcelona [Acceso 15 de septiembre de 2009] Disponible en: www.actualidaddermatol.com/art41103.pdf
29. Bowman, D. Lynn, R. Eberhard, M. Georgis‘Parasitology for veterinarians. 8ª ed. Madrid: Elservier, 2004
30. Gállego, J. Manual de parasitología. Morfología y biología de los parásitos de interés sanitario. España: Publicacions I Edicions de la Universitat de Barcelona, 2006.
31. Doreste, E. Acarología. 2ª ed. Costa Rica: IICA, 1988.
32. Hernández, H. Mendiola, J. Fernández, A. Valdéz, M. Identificación de una proteasa neutra en intestino de Boophilus microplus por electroforesis en geles de poliacrilamida copolimerizados con gelatina. Rev Cubana Med Trop, 2000; 52(3): 165- 169.
33. Stafford III, K. Tick Management Handbook. The Connecticut Agricultural Experiment Station The Connecticut General Assembly. Disponible en: http://www.cdc.gov/ncidod/dvbid/lyme/resources/handbook.pdf
34. Rosario, R. Domínguez, D. Hernández, R. Rojas, E. Estrategias para el control integral de la garrapata Boophilus microplus y la mitigación de la resistencia. [monografía en internet], Cuernavaca: UAM [acceso 4 de octubre de 2009].
35. Capitulo XXIV. Las garrapatas “Ticks” (Ixodida). Disponible en: http://academic.uprm.edu/dpesante/0000/capitulo-24.PDF
36. Willadsen, P. Immunological control of ectoparasites: past achievements and future research priorities. Genetic analysis: Biomolecular Enginnering, 1999; 15: 131 – 137.
37. Oteo, J. Blanco, J. Ibarra, V. ¿Podemos prevenir las enfermedades trasmitidas por garrapatas? Enferm Infecc Microbiol Clin, 2001; 19: 509-513.
38. Rodriguez, M. Penichet, M. Mouris, A. Labarta, V. Luaces, L. Rubiera, R. Sanchez, P. Control of Boophilus microplus populations in grazing cattle vaccinated with a recombinant Bm86 antigen preparation. Veterinary Parasitology, 1995; 57: 339 – 349.
39. Rodriguez, M. Massard, C. Da Fonseca, A. Fonseca, N. Machado, H. Labarta, V. De la Fuente, J. Effect of vaccination with a recombinant Bm86 antigen preparation in natural infestations of Boophilus microplus in grazing dairy and beef pure and cross-bred cattle in Brazil. Vaccine, 19 95; 13 (18): 1804 – 1808.
40. Labarta, V. Rodriguez, M. Penichet, M. Lleonart, R. Lorenzo, L. De la Fuente, J. Simulation of control strategies for the cattle tick Boophilus microplus employing vaccination with a recombinant Bm86 antigen preparation. Veterinary parasitology, 1996; 63: 131-160.
41. Sossai, S. Peconick, P. Sales- junior, P. Marcelino, F. Vargas, M. Neves, E. Patarroyo, J. Polymorphism of the bm86 gene in South American strains of the cattle tick Boophilus microplus. Experimental and Applied Acarology, 2005; 37: 199 -214.
42. Gallardo, J. Morales, J. Boophilus microplus (Acari: Ixodidae): pre ovoposición, ovoposición,incubación de los huevos y geotropismo. Bioagro, 1999; 11 (3): 77 - 87.
43. Rand, K. Moore, T. Sriskantha, A. Spring, K. Tellam, R. Willadsen, P. Cobon, G. Cloning and expression of a protective antigen from the cattle tick Boophilus microplus. Proc. Natl. Acad. Sci. USA, 1989; 86: 9657 – 9661.
44. Canales, M. Perez, J. Naranjo,V. Nijhof, A. Hope, M. Jorgejan, F. De la Fuente, J. Expression of recombinant Rhipicephalus (Boophilus) microplus, R.annulatus and R.decoloratus Bm86 orthologs as secreted proteins in Pichia pastoris. BCM Biotechnology. 2008; 8: 14.
45. Da Silva, I. Imamura, S. Nakajima, C. Cardoso, F. Sanchez, C. Renard, G. Masuda, A y col. Molecular cloning and sequence analysis of cDNAs encoding for Boophilus microplus, Haemaphysalis longicornis and Rhipicephalus appendiculatus actins. Veterinary Parasitology,2005; 127: 147–155.
46. Kocan, K. Targeting ticks for control of selected hemoparasitic diseases of cattle. Veterinary Parasitology, 1995; 57: 121 – 151.
47. Bram, R. Anaplasmosis and babesiosis; the chemical control of ticks; and acaricide resistance and alternate methods of tick control. Reported of FAO.1990.
48. El manual Merck de veterinaria. 5ª Ed. Barcelona: Océano Centrum, 2000.
49. Villar, C. Martínez, G. Niveles de infestación por la garrapata Boophilus microplus en la progenie de dos toros San Martinero suplementados con flor de azufre. Rev. Técnico científica, 1996.
50. Vizcaíno, O. Benavides, E. Vacuna colombiana contra anaplasmosis y babesiosis bovinas: la alternativa más eficaz y económica para el control de estos hemoparásitos. [Monografía en internet], Colombia: Corpoica; 2004 [acceso 29 de septiembre de 2009] Disponible en: http://www.cundinamarca.gov.co/cundinamarca/archivos/FILE_EVENTOSENTI/FILE_EVENTOSENTI11832.pdf
51. Patarroyo, J. Portela, R. De Castro, R.Couto, J. Guzman, F. Patarroyo, R y col. Immunization of cattle with synthetic peptides derived from the Boophilus microplus gut protein (Bm86). Veterinary Immunology and Immunopathology, 2002; 88: 163–172.
52. Piper, E. Jonsson, N. Gondro, C. Lew, A. Moolhuijzen, P. Vance, M. Jackson, L. Immunological Profiles of Bos taurus and Bos indicus Cattle Infested with the Cattle Tick, Rhipicephalus (Boophilus) microplus. Clinical and Vaccine Immunology, 2009; 16 (7); 1074 – 1086.
53. Jonsson, N. Mayer, G. Matschoss, L. Green, E. Ansell, J. Production effects of cattle tick (Boophilus microplus) infestation of high yielding dairy cows. Veterinary Parasitology, 1998; 79 (1): 65-77.
54. Fernández, R. Cruz, V. Solano, V. García, V. Anti-tick effects of Stylosanthes humilis and S.hamata on plots experimentally infestated with Boophilus microplus larvae in Morelos, Mexico. Exp. Appl. Acarol, 1999; 23: 171 – 175.
55. Giraldo, C. Uribe, F. Manejo integrado de garrapatas en sistemas sostenibles de producción ganadera. [Monografía en internet], Colombia: Corpoica; 2007 [acceso 25 de Junio de 2010] Disponible en: http://www.corpoica.org.co/SitioWeb/Archivos/Conferencias/MetalternConTc.pdf .
56. Fernandez, M. Zhioua, E. García, Z. Infectivity of Metarhizium anisopliae to susceptible and organophosphate-resistant Boophilus microplus strains. Téc Pecu Méx, 2005; 43 (3): 433 - 440.
57. Brum, J. Disease in engordet females of Boophilus microplus caused by Cedacea lapagei and Escherichia coli. Arquivo Brasilero de medicina veterinaria e Zootecnia, 1992; 44 (6): 543 -544.
58. Coronado, A. Mujica, F. Acaricide resistance in Boophilus microplus in Venezuela. Bioagro, 1997; 3 (1): 5 -14.
59. Patarroyo, J. Sossai, S. Alternativas para o controle de carrapatos: Vacinas e medicamentos. [monografía en internet], Brasil: Instituto de Biotecnologia Aplicada À Agropecuária [acceso 5 de Mayo de 2010].
60. Guglielmone, A. Castelli, M. Mangold, A. Aguirre, D. Alcaraz, E. Cafrune, M. Cetrá, B. Luciani, C. El uso de acaricidas para el control de Rhipichepalus (Boophilus) microplus (Canestrini) (Acari: Ixodidae) en la Argentina. Ria, 2007; 36 (1): 155 – 167.
61. Gil, P. Medicina preventiva y salud pública. 10° ed. Barcelona: Masson S.A. 2002.
62. Ghosh, S. Azhahianambi, P. Yadav, M. Upcoming and future strategies of tick control: a review. J Vect Borne Dis, 2007; 44: 79–89.
63. Graf, J. Gogolewski, R. Leach-Bing, N. Sabatini, G. Molento, M. Bordin, E. Arantes, G. Tick control: An industry point of view. Parasitology, 2004; 129: 427- 442. 2004.
64. Armendáriz, I. Report of a case of multiple resistance to ixodicides on Boophilus microplus Canestrini (Acari: Ixodidae) in Tamaulipas, Mexico. Vet. Mex., 2003; 34 (4): 397- 401.
65. Klafke, G. Sabatini, G. De Albuquerque, T. Martins, J. Kemp, D. Miller, R. Schumaker, T. Larval immersion tests with ivermectin in populations of the cattle tick Rhipicephalus (Boophilus) microplus (Acari: Ixodidae) from State of Sao Paulo, Brazil. Veterinary Parasitology, 2006; 142: 386–390.
66. Li, A. Davey, R. Miller, R. George, J. Detection and characterization of Amitraz resistance in the southern cattle tick, Boophilus microplus (Acari: Ixodidae). J. Med. Entomol, 2004; 41 (2): 193 – 200.
67. Alonso, M. Rodriguez, R. Fragoso, H. Rosario, R. Ixodicide resistance of the Boophilus microplus tick to ixodicides. Arch.Med.Vet, 2006; 38 (2): 105 – 114.
68. Hernandez, R. Chen, A. Davey, R. Ivie, G. Wagner, G. George, J. Comparison of genomic DNA in various strains of B. microplus (Acari: Ixodidae). J. Med. Entomol, 1998; 35: 895 - 900.
69. Pruett, J. Immunological intervention for the control of ectoparasites of livestock- A review. J.Vet. Parasitol, 2002; 16(1): 1 -10.
70. Cardozo, N. Resistencia de la garrapata (B.microplus) a los acaricidas. Laboratorio Santa Elena, Uruguay, 2007.
71. Jonsson, N. Programas de Control Integrado de Garrapatas en Ganado: Un Examen de Algunos Posibles Componentes. Disponible en: http://pwp.007mundo.com/saludanimal/documentos05/EnfoContrGarr.pdf
72. Mangold, A. Castelli, M. Nava, S. Aguirre, D. Guglielmonechi, A. Poblaciones de la garrapata Rhipicephalus (Boophilus) microplus resistentes a los piretroides en Córdoba y Salta, Argentina. Revista FAVE - Ciencias Veterinarias, 2004; 3: 55 – 59.
73. Domínguez, D. Rosario, R. Almazán, C. Saltijeral, J. De la Fuente, J. Boophilus microplus: biological and molecular aspects of acaricide resistance and their impact on animal health. Tropical and Subtropical Agroecosystems, 2010; 12: 181 – 192.
74. Roush, R. Ocurrence, genetics and management of insecticida resistance. Parasitology Today, 1993; 9: 174-179.
75. Marin, F. Resitencia a ixodicidas en garrapatas Boophilus microplus. Disponible en: http://cedhyp.uat.edu.mx/pdf/027.pdf
76. IICA. Salud animal. I Reunión de la comisión interamericana de salud animal. Mexico, 1983.
77. De la Fuente, J. Rodriguez, M. Montero, C. Redondo, M. García- García, J. Mendez, L. Serrano, E. Vaccination against ticks (Boophilus spp.): the experience with the Bm86-basedvaccine GavacTM. Genetic Analysis: BiomolecularEngineering, 1999; 15: 143 -148.
78. Almazán, C. Kocan, K. Blouin, E. De la Fuente, J. Vaccination with recombinant tick antigens for the control of Ixodes scapularis adult infestations. Vaccine, 2005; 23: 5294 – 5298.
79. Willadsen, P. Tick control: Thoughts on a research agenda. Veterinary parasitology, 2006; 138: 161 -168.
80. William, S. Kocan, A. Margo,P. Parasitic diseases of wild mammals. 2ª ed. Estados unidos de América: Library of Congress Cataloging; 2001.
81. Willadsen, P. Anti-tick vaccines. Parasitology, 2004; 129: 367 -387.
82. Brossard, M. Wikel, S. Immunology of interactions between ticks and hosts. Medical and veterinary entomology, 1997; 11: 270 – 276.
83. Xu, Y. Bruno, J. Luft, J. Identification of novel tick salivary gland proteins for vaccine development. Biochemical and Biophysical Research Communications, 2005; 326: 901–904.
84. Willadsen, Vaccination against ticks and the control of tick-borne disease. Disponible en: http://www.iaea.org/nafa/d3/public/willadseniaea-sept03-revised.pdf
85. Brossard, M. Wikel, S. Tick immunobiology. Parasitology, 2004; 129: 161 – 176.
86. Willadsen, P. Jongejan, F. Immunology of the tick-host interaction and the control of ticks and tick-borne diseases. Parasitol today, 1999; 15 (7): 258 -262.
87. Trimnell, A. Davies, G. Lissina, O. Hails, R. Nuttall, P. A cross-reactive tick cement antigen is a candidate broad-spectrum tick vaccine. Vaccine, 2005; 23: 4329 – 4341.
88. Muelanga, A. Sugimoto, C. Onuma, M. Issues in tick vaccine development: identification and characterization potential candidate vaccine antigens. Microbes and Infection, 2000; 2: 1353 – 1361.
89. Willadsen, P. Novel vaccines for ectoparasites. Veterinary Parasitology, 1997; 71: 209-222.
90. Nattall, P. Trimnell, A. Kazimirova, M. Labuda, M. Exposed and concealed antigens as vaccine targets for controlling ticks and tick-borne diseases. Parasite Immunology, 2006; 28: 155–163.
91. Willadsen, P. The molecular revolution in the development of vaccines against ectoparasites. Veterinary Parasitology, 2001; 101: 353–367.
92. Willadsen, P. Immunological control of ectoparasites: past achievements and future research priorities. Genetic Analysis: Biomolecular Engineering, 1999; 15: 131 – 137.
93. Willadsen, P. Mc keinna, R. Rinding, G. Isolation from the cattle tick control. Parasitology Today, 1988; 4.
94. García, A. Barral, M. Métodos de control de las garrapatas. Rev. Ovis, 1999; 65.
95. Penichet, M. Rodríguez, M. Castellano, O. Mandado, S. Rojas, Y. Rubiera, R. Sánchez, P y col. Detection of Bm86 antigen in different strains of Boophilus microplus and effectiveness of immunization with recombinant Bm86. Parasite Immunology, 1994; 1(6): 493-500.
96. Boué, O. Redondo, M. Montero, C. Rodríguez, M. De la Fuente, J. Reproductive and safety assessment of vaccination with GavacTM against the cattle tick (Boophilus microplus). Theriogenology, 1999; 51: 1547 – 1554.
97. Riding, G. Jarmey, J. McKenna, R. Pearson, R. Cobon, G. Willadsen, P. A protective “concealed” antigen from Boophilus microplus. Purification, localization, and possible function. J Immunol, 1994; 153 (11): 5158 – 5166.
98. Willadsen, P. Smith, D. Cobon, G. McKenna, R. Comparative vaccination of cattle against Boophilus microplus with recombinant antigen Bm86 alone or in combination with recombinant Bm91. Parasite Immunology, 1996; 18 : 241 – 246.
99. Hernandez, R. Chen, A. Davey, R. Ivie, G. Wagner, G. George, J. Comparison of genomic DNA in various strains of B. microplus (Acari: Ixodidae). J. Med. Entomol, 1998; 35: 895 - 900.
100. Mendiola, J. Hernández, H. Finlay, C. Actividad semejante a catepsina L en la hemolinfa de hembras repletas de Boophilus microplus. Rev Cubana Med Trop, 1999; 51(3):201-203.
101. Tellam, R. Kemp, D. Riding, G. Briscoe, S. Smith, D. Sharp, P. Irving, D y col. Reduced oviposition of Boophilus microplus feeding on sheep vaccinated with vitellin. Vet Parasitol, 2002; 103(1 2):141- 156.
102. Peconick, A. Sossai, S. Girào, M. Rodriguez, C. Souza e Silva, F. Guzman Q. Patarroyo, A y col. Synthetic vaccine (SBm 7462) against the cattle tick Rhipicephalus (Boophilus) microplus: Preservation of immunogenic determinants in different strains from South America. Experimental Parasitology, 2008; 119: 37–43.
103. Andreotti, R. Performance of two Bm86 antigen vaccin formulation against tick using crossbreed bovines in stall test. Rev. Bras. Parasitol. Vet., 2006; 15(3): 97-100.
104. Turnbull, I. Smith, D. Sharp, P. Cobon, G. Hynes, M. Expression and secretion in Aspergillus nidulans and Aspergillus niger of a Cell Surface Glycoprotein from the Cattle Tick, Boophilus microplus, by Using the Fungal amdS Promoter System. Applied and environmental microbiology, 1990; 56 (9): 2847 – 2852.
105. Hernandez, H. Mendiola, J. Fernández, A. Valdéz, M. identificación de una proteasa neutra en intestino de Boophilus microplus por electroforesis en geles de poliacrilamida copolimerizados con gelatina. Revista Cubana de Medicina Tropical, 2000; 52 (3).
106. Willadsen, P. Riding, G. McKenna, R. Kemp, D. Tellam, R. Nielsen, J. Lahnstein, J y col. Immunologic control of a parasitic arthropod. Identification of a protective antigen from Boophilus microplus. J Immunol. 1989; 143(4): 1346 – 1351.
107. Tellam, R. Smith, D. Kemp, D. and Willadsen, P. Animal Parasite Control Utilizing Biotechnology. Florida: W.K. Young, 1992.
108. Nijhof, A. Balk, J. Postigo, M. Rhebergen, A. Taoufik, A. Jongejan, F. Bm86 homologues and novel ATAQ proteins with multiple epidermal grow factor (EGF)- like domains from hard and soft ticks. Int. J. Parasitol, 2010.
109. Jonsson, N. Matschoss, A. Pepper, P. Green, P. Albrecht, M. MHungerford, J. Ansell, J y col. Evaluation of TickGARDPLUS , a novel vaccine against Boophilus microplus, in lactating Holstein–Friesian cows. Veterinary Parasitology, 2000; 88: 275–285.
110. Peconick, A. Conservacao de seqüências núcleotídicas do gene bm86 e das seqüências peptídicas 4822 e 4823, constituintes da vacina sintética SBm 7462. [Magister]. Brasil. Universidade Federal de Vicosa, 2006.
111. Willadsen, P. Kemp, D. Cobon, G. Wright, I. Successful vaccination against Boophilus microplus and Babesia bovis using recombinant antigens. Mem. Inst. Oswaldo Cruz, 1992; 87 (3): 289 – 294.
112. Fragoso, H. Hoshman, R. Ortiz, M. Rodriguez, M. Redondo, M. Herrera, L, de la Fuente, J. Protection against Boophilus annulatus infestations in cattle vaccinated with the B.microplus Bm86- containing vaccine Gavac. Vaccine, 1998;16 (20): 1990 – 1992.
113. Parizi, L. Protecao cruzada contra a infestacao de Rhipicephalus (Boophilus) microplus en bovinos vacinados com a Glutationa-s- transferase recombinante de Haemaphysalis longicornis. [Postgrado]. Porto Alegre. Universidade Federal do Rio Grande do Sul (UFRGS), 2010.
114. Pruet. J. Untalan, P. Davey, B. Identification and partial purification of serologically defined Boophilus microplus larval antigens by natural ectoparasite exposure. Veterinary Parasitology, 2006; 140: 148 – 157.
115. Rodríguez, M. Montero, C. Machado, H. Joglar, M. The evaluation of yeast derivatives as adjuvants for the immune response to the Bm86 antigen in cattle. BCM Biotechnology, 2001; 1(2).
116. Aplicación del control integrado de parasites (CIP) a la garrapata Boophilus microplus en Uruguay. FAO, 2007. Disponible en: http://www.rlc.fao.org/es/ganaderia/pdf/cip.pdf
117. Opdebeeck, J. Wong, J. Jackson, L. Dobson, C. Vaccines to protect Hereford cattle against the cattle tick, Boophilus microplus. Immunology, 1988; 63: 363 -367.
118. Betancourt, J. Nuevas Opciones para la lucha contra las garrapatas y los hemoparásitos de bovinos en Colombia. Revista regional Novedades técnicas, Coorpoica, 2005; 6 (6): 39 – 44.
119. Bautista, C. Interacciones artrópodo – respuesta inmune del huésped. Ciencia Veterinaria, 1987; 4: 87 – 130.
120. Pipano, E. Alekceev,E. Galker, F. Fish, L. Samish, M. Shkap, V. Immunity against Boophilus annulatus induced by the Bm86 (Tick-GARD) vaccine. Experimental and applied acarology, 2003; 29: 141-149.
121. Vos, S. Zeinstra, L. Taoufik, O. Willadsen, P. Jongejan, F. Evidence for utility of the Bm86 antigen from Boophilus microplus in vaccination against other tick species. Experimental and Applied Acarology, 2001; 25: 245–261.
122. Canales, M. Almazán, C. Naranjo, V. Jongejan, F. De la Fuente, J. Vaccination with recombinant Boophilus annulatus Bm86 ortholog protein, Ba86, protects cattle against B. annulatus and B. microplus infestations. BMC Biotechnology, 2009; 9 (29): 1 – 8.
123. García- García, J. González, I. González, D. Valdés, M. Mendéz, L. Lamberti, J. Rodríguez, M y col. Sequence variations in the Boophilus microplus Bm86 locus and implications for immunoprotection in cattle vaccinated with this antigen. Experimental and Applied Acarology, 1999; 23: 883 -895.
124. Guglielmone, A. Mangold, A. Garrapata común de los bovinos. Disponible en: http://www.inta.gov.ar/ediciones/idia/carne/carnes08.pdf
125. Baxter, G. Barker, S. Acetylcholinesterase cDNA of the cattle tick, B.microplus: characterization and role in organophosphate resistence. Insect Biochem. Mol. Bio., 1998; 28: 581 – 589.
126. García- García, J. Montero, C. Redondo, M. Vargas, M. Canales, M. Boueb, O. Rodríguez, M y col. Control of ticks resistant to immunization with Bm86 in cattle vaccinated with the recombinant antigen Bm95 isolated from the cattle tick, Boophilus microplus. Vaccine, 2000; 18: 2275 – 2287.
127. De la Fuente, J. García- García, J. González, D. Izquierdo, G. Ochagavia, M. Molecular analysis of Boophilus spp. (Acari: Ixodidae) Tick strains. Vet Parasitol, 2000; 92 (3): 209 – 222.
128. Hernandez, R. Chen A. Waghela S. Ivic G. George J. Wagner G. Identification of a point mutation in an esterase gene in different populations of the southern cattle tick, B. microplus. Insect Biochem. Mol. Biol, 2000; 30: 969 – 977.
129. Passos, D. Ferreira, C. Da Silva, S. Richter, M. Ozaki, L. Detection of genomic variability in different populations of the cattle tick Boophilus microplus in southern Brazil. Vet Parasitol, 1999, 87 (1): 83 – 92.
130. Labruna, M. Naranjo, V. Mangold, A. Thompson, C. Estrada-Peña, A. Guglielmone, A. Jongejan, F y col. Allopatric speciation in ticks: genetic and reproductive divergence between geographic strains of Rhipicephalus (Boophilus) microplus. BMC Evolutionary Biology, 2009; 9 (46): 1 – 12.
131. Mans, B. Neitz, A. Adaptation of ticks to a blood-feeding environment: evolution from a functional perspective. Insect Biochem Mol Biol, 2004; 34 (1): 1 -17.