Lucia Constanza Corrales, MSc1, Ligia Consuelo Sánchez MSc1, Jairo Cuervo PhD2, Julie Alexandra Joya3, Katherine Marquez3
1Docentes investigadoras. Universidad Colegio Mayor de Cundinamarca. Bogotá, Colombia.
2Docente investigador. Universidad Nacional de Colombia.
3Estudiantes. Programa de Bacteriología y Laboratorio Clínico, Facultad de Ciencias de la Salud. Universidad Colegio Mayor de Cundinamarca. Bogotá, Colombia.
Recibido: 02-03-2012 Aceptado: 19-05-2012
Palabras clave: Control biológico, antagonismo, bacilos Gram positivos, marchitez vascular, aromáticas.
Biocontrol effect of Bacillus spp, against Fusarium sp., under greenhouse
conditions in thyme plants (Thymus vulgaris L.)
The development of different strategies different to agrochemicals in agriculture has opened new possibilities for research with microbes as biological control alternative, given its biochemical abilities and ease of use for crop protection. The aim of this study was to establish the biocontrol effect of Bacillus spp., against Fusarium sp., under greenhouse conditions in thyme. The methodology included isolation of possible pathogen causing vascular wilt and yield losses, its identification by taxonomic keys, evidence of direct antagonism plate where the radius of colony growth was evaluated, percentage of inhibition and growth rate, tests undergreenhouse conditions in thyme plants assessed every 5 days for 1 month by severity scale. Finally, we confirmed the presence of the pathogen in a second isolation in order to confirm Koch’s postulates. The results showed that the cause of the disease was the fungi Fusarium pseudonygamai . Antagonism test showed that treatment with Bacillus UCMC (B2) had the best biocontrol effect in vitro and under greenhouse conditions against Fusarium sp, giving its highest percentages of inhibition, longer roots, increased dry weight and decrease or absence of disease symptoms. It was concluded that among the microorganisms under study, Bacillus UCMC (B2) had the best potential biocontrol under greenhouse conditions against Fusarium sp in thyme plants.
Keywords: biological control, antagonism, bacilli gram positive, vascular wilt, aromatics.
En el ámbito comercial el cultivo de tomillo es altamente rentable, se pueden sembrar 100.000 plantas por hectárea, y obtener 4 cortes al año, con rendimientos de unas 18 Ton/ha en fresco; cuando se trata deshidratado, se puede obtener hasta 3 Ton/ha de tomillo seco y cerca de 50 kg/ha de aceite esencial. En Colombia, se paga por cada plántula unos US$0.17 y se comercializan bolsas de 50 gramos de producto fresco por valor de US$0.40 y el costo unitario de producción bajo agricultura orgánica, de US$0.15 por kilo, lo que lo hace económicamente atractivo (4).
En los invernaderos de la Facultad de Agronomía de la Universidad Nacional de Colombia, Sede Bogotá se observó que las plantas de tomillo pertenecientes al grupo de hierbas aromáticas las cuales eran producidas y vendidas frescas a consumidores y agricultores particulares para ser utilizadas por estos últimos como material de propagación para establecer sus propios cultivos, presentaban síntomas característicos de marchitamiento vascular ocasionado por Fusarium sp. Esta enfermedad de difícil manejo ha acabado con gran parte de la producción total de estos cultivos afectando la ganancia de casi 100 millones de pesos de ingreso bruto que se obtienen de la negociación anual de su venta y al mismo tiempo está sirviendo como fuente de inóculo del patógeno.
Por otro lado, existen múltiples factores que son limitantes en la producción de hierbas aromáticas y no son tenidos en cuenta cuando se buscan patógenos causantes de enfermedades, entre otros, factores agronómicos como la selección del material de propagación libre de patógenos, conocimiento de la fenología, adaptación de la variedad, tipo de suelo, requerimientos hídricos y nutricionales, factores climáticos e implementos agrícolas que pueden causar daño a las plantas, así como el uso indiscriminado de agroquímicos que ha favorecido el aumento de enfermedades virales, fúngicas, bacterianas y por nematodos.
La implementación del control biológico de enfermedades en plantas es una alternativa para el medio ambiente y una forma de dar cumplimiento a las exigencias de otros países en lo referente a residualidad de agroquímicos por la mayor eficiencia respecto al uso de otras prácticas de control tradicional ya que aunque los antagonistas pueden actuar en forma más lenta y en menor escala, su acción puede ser más estable y duradera que el control químico (5).
El control biológico se define según Cook y Baker, (1983): “como la reducción de la densidad del inóculo o de las actividades de un patógeno que produce una enfermedad, por uno o más organismos, en forma natural a través de la manipulación del medio ambiente, hospedero o antagonista”(6). De esta manera, es posible lograr un cultivo sano con el mínimo de pérdidas para el agricultor.
Existe un grupo importante de bacterias que presentan efectos antagónicos con otros microorganismos y esta acción puede ser aprovechada como una forma de control biológico de patógenos vegetales (7). Las bacterias son parte de las cadenas alimenticias del suelo, sirviendo de alimento a otros microorganismos como protozoarios, los cuales pueden ser antagonistas de organismos fitopatógenos.
En fitopatología tiene gran importancia el antagonismo dado por bacterias saprofíticas con especies de hongos. Entre las bacterias más estudiadas como antagonistas de fitopatógenos se encuentra Pseudomonas spp. y Bacillus spp(6-7).
Trabajos previos y simultáneos con otras especies aromáticas y ornamentales realizados en el grupo de investigación CEPARIUM de la Universidad Colegio Mayor de Cundinamarca aislaron e identificaron microorganismos asociados a la rizósfera con potencial antagonista contra Fusarium oxysporum. El objetivo de este proyecto fue establecer cuáles de los seis (6) Bacillus spp., aislados de rizósfera tuvieron efecto biocontrolador bajo condiciones de invernadero frente a un aislamiento de Fusarium sp., causante del marchitamiento vascular en plantas de tomillo (Thymus vulgaris L.).
La metodología incluyó la valoración del porcentaje de inhibición, peso seco y disminución de la severidad de la enfermedad como variables para seleccionar el microorganismo más efectivo. Se espera en trabajos futuros establecer la cinética de este microorganismo, su potencial genético, la confirmación de su identidad y la obtención de los metabolitos que realizan la acción antibiótica contra Fusarium sp., para contribuir en el control de la marchitez vascular en aromáticas especialmente en tomillo, pero también en otros cultivos atacados por este hongo.
Material Biológico.Se utilizaron seis cepas de bacterias que habían sido aisladas de rizósfera de aromáticas, Tabla 1, por el grupo de investigación CEPARIUM de la Universidad Colegio Mayor de Cundinamarca en proyectos anteriores y que estaban conservadas en congelación a -20ºC en caldo infusión cerebro corazón (BHI) mas glicerol al 10%(8). El procedimiento para la descongelación de las seis bacterias en estudio fue el de Corrales y Sánchez, 2005 (8).
1. Aislamiento e identificación del patógeno. El material vegetal de tomillo con los síntomas típicos de la enfermedad del marchitamiento vascular; primero perdida de turgencia, debilidad y tonalidad de las hojas que va de verde claro a amarillo verdoso; y luego una coloración amarillenta, necrosis y muerte de la planta (9), se recolectó en los cultivos de la Facultad de Agronomía de la Universidad Nacional de Colombia Sede Bogotá.
Para el aislamiento del microorganismo se tomaron tallos de plantas de tomillo que presentaban síntomas de necrosis del sistema vascular; luego en condiciones totalmente asépticas y bajo una cámara de flujo laminar se sometieron a una desinfección preliminar con tween 80 y agua estéril, se colocaron en hipoclorito de sodio al 1% durante un minuto con agitación permanente, pasado este tiempo se sumergieron en etanol al 70% durante 30 segundos, con agitación; luego se realizaron cortes del tejido enfermo, posteriormente las muestras fueron lavadas tres veces con agua destilada estéril para eliminar los excesos del desinfectante y luego secadas con papel toalla estéril (9-10).
Una vez desinfectado el material del cual se deseaba aislar por primera vez el patógeno se cortaron cuatro segmentos de 1 cm2 para sembrar dos en cada caja con PDA (11). Posteriormente, se tomaron con una pinza estéril y se colocaron sobre el medio de cultivo papa-dextrosa-agar (PDA), para luego ser incubados durante ocho días a una temperatura de 22ºC.
Adicionalmente, se utilizó el método en cámara húmeda para aquellos tallos que no presentaran signos muy evidentes. Se esterilizaron las cámaras húmedas, se colocaron las porciones lavadas y desinfectadas, se sellaron con papel vinipel, se incubaron a temperatura ambiente hasta los ocho días que se observó la presencia de cuerpos fructíferos desarrollados sobre la superficie del tejido. Se transfirió el micelio o cuerpos fructíferos a un medio de cultivo en placa (PDA), se incubaron a una temperatura de 22ºC por ocho días.
Tabla 1. Aislamientos bacterianos.

Una vez que el hongo inoculado creció se realizó un aislamiento secundario a placas con medio de cultivo PDA y finalmente cuando se observó que el hongo crecía sin la contaminación de otros microorganismos, se transplantó por duplicado a tubos y cajas con medio de cultivo PDA. La identificación del hongo se efectúo por medio de la técnica de microcultivo a través de la observación al microscopio óptico. Con tinción de azul de lactofenol se determinó la morfología del micelio, tipo de esporas, conidias, monofiálides y clamidosporas producidas. Se observaron además características macroscópicas como, tipo de colonia, producción de pigmentos y color del micelio; mediante la ayuda de claves taxonómicas del Manual FUSKEY especializadas en la identificación de especies del genero Fusarium, se comprobaron las características anotadas anteriormente (12).
2. Verificación de antagonismo in vitro. Los bacilos a utilizar en el estudio fueron descongelados de acuerdo con el protocolo de Sánchez y Corrales, cinco días antes del ensayo y se realizó una siembra directa en agar sangre, agar Mac. Conkey y agar nutritivo con NaCl al 1% a 37°C por 18 horas, la primera para observar viabilidad y hemólisis y los otros dos medios para confirmar que no hubiese contaminación con otros microorganismos.
Se realizó lectura de las siembras a las 24 y 48 horas para observar viabilidad (8).
La pureza a se confirmó por observación microscópica con coloración de Gram. Los seis microorganismos utilizados fueron identificados plenamente en el laboratorio de la Universidad Colegio Mayor de Cundinamarca por crecimiento en medios selectivos, coloración de Gram, pruebas bioquímicas en tubo y por el sistema automatizado BBL® Crystal™ para bacterias Gram positivas, las cuales reportaron entre un 98 y 99% de confiabilidad (8).
Una vez aislados e identificados los microorganismos se llevaron a enfrentamiento directo dual en medio PDA, como se explica a continuación: en agar PDA se sembraron los morfotipos de bacterias, en dos líneas paralelas, cada una a un centímetro de distancia del borde de la caja de petri, se llevaron a incubar por 48 horas a 37ºC. Cada caja se sembró con dos morfotipos diferentes. Se realizaron tres repeticiones para cada combinación.
Una vez cumplido el tiempo, se colocó un disco de 0.5 cm2 de diámetro en el centro de las cajas de agar con el fitopatógeno Fusarium sp. y se incubaron los ensayos a 25ºC.
Como testigo absoluto se sembró solo el hongo fitopatógeno en medio PDA. La lectura del crecimiento fúngico se llevó a cabo al tercero, quinto y séptimo día de incubación (8). Los halos de inhibición se midieron partiendo del borde externo del hongo hasta la línea donde se encuentra la bacteria. Se tomaron como positivos aquellos aislamientos que presentaron halos de inhibición, limitantes los que presentaron un crecimiento micelial del hongo hasta las líneas con la bacteria sin alcanzar el borde de la caja, y negativos aquellos donde el hongo llego hasta el límite de la caja de petrí pasando por encima de las líneas con la bacteria (13).
La tasa de crecimiento micelial se dio en centímetros por día, se determinó teniendo en cuenta el radio de crecimiento micelial de la colonia fungica calculando su magnitud mediante la expresión sugerida por Mead 1993 (14).
T.C=(Cf-Ci)/(Tf-Ti), donde Cf es el crecimiento final expresado en cm, Ci es el crecimiento inicial expresado en cm, Ti es el tiempo final y Ti es el tiempo inicial (14) El porcentaje de inhibición se calculó utilizando la siguiente formula (14):
Porcentaje de inhibición = (R1-R2)/ (R1) x 100. Donde R1 es el radio de crecimiento del hongo solo y R2 el radio de crecimiento del hongo frente a la bacteria.
Una vez verificado el antagonismo se procedió a seleccionar las bacterias con mejor comportamiento para ser probadas bajo condiciones de invernadero.
3. Pruebas bajo condiciones de invernadero
Para las pruebas bajo condiciones de invernadero se contó con el invernadero N° 8 cama 3, de estructura metálica, con cubierta de polietileno y polisombra 70, camas de concreto elevadas, bajo una temperatura aproximada de 18 a 20 ºC de la Facultad de Agronomía de la Universidad Nacional de Colombia, Sede Bogotá, Figura 2.
Se realizó el seguimiento a las 42 plantas seleccionadas midiendo longitud total, longitud de la parte aérea, longitud de la raíz y número de ramas al inicio y final del ensayo bajo condiciones de invernadero, Figura 2.
Preparación inóculo del patógeno
Se utilizaron cultivos de una semana de crecimiento en Agar Papa Dextrosa (PDA), los cuales fueron utilizados para la preparación de una suspensión de esporas. Se agregaron 20 ml de agua destilada estéril a la caja de Petri que contenía el cultivo del hongo patógeno y se hizo una suspensión con la totalidad del hongo que contenía el cultivo, fue filtrada con gasa estéril en un beaker que contenía 75 ml de agua destilada estéril como se observa en la Figura 3.

Figura 1. Invernadero N° 8 cama 3 de la Facultad de Agronomía de la Universidad Nacional de Colombia Sede Bogotá, en donde se realizó el ensayo bajo condiciones controladas. Joya y Márquez. 2010.

Figura 2. Plantas de tomillo (Thymus vulgaris L.) de 15 días de crecimiento sembradas en bandejas con turba. Joya y Márquez. 2010.
Figura 3. Preparación de suspensión de esporas. a. Raspado del hongo. b. Filtrado del hongo, Joya y Márquez. 2010
Luego se agitó la suspensión en un vortex durante un minuto. El recuento de esporas se hizo a partir de una suspensión celular realizada en Tween 80 al 0.03% en tubo falcon, de donde se realizaron diluciones de 10-1 y de 10-2 en tubos eppendorf, de la última dilución se tomaron 50 l y utilizando la cámara de Neubauer en un microscopio óptico con aumento 40X se realizó el recuento de esporas, contando los cuadrantes de las esquinas y el de la mitad. La concentración de esporas fue ajustada a una concentración de 1x104 esporas/ml en condiciones asépticas utilizando la formula Nº de conidias totales x 25 x 104 x dilución (102) / 5 = Nº de conidias/ ml (15).
Los tratamientos y controles de los biocontroladores fueron sumergidos en frascos de vidrio que contenían la suspensión del biocontrolador estándar de Mac Farland de 1 x 108 cel/ml durante 15 minutos, Figura 5, y se sembraron en vasos desechables de 250 ml previamente con turba estéril humedecida. Se establecieron tres repeticiones por tratamiento.
Preparación inóculo de los biocontroladores
Los aislamientos de bacterias fueron incrementados masivamente en agar nutritivo durante 24 horas y el ajuste de la concentración se realizó por el método de turbidez óptica con el estándar de Mac Farland de 1x108 cel/ml (tubo número 3) en beaker con 50 ml de caldo BHI (8).
Inoculación del biocontrolador
A las 42 plantas de tomillo seleccionadas se les removió el exceso de turba con agua destilada, posteriormente se pasaron por una solución de hipoclorito de sodio y finalmente se lavaron con agua destilada estéril. Para la inoculación del patógeno se causó con ayuda de un bisturí una herida de 1 cm en la base del tallo, Figura 5, para facilitar el ingreso del microorganismo y disminuir el tiempo de incubación.

Figura 4. Preparación del tejido vegetal para la inoculación del biocontrolador. Joya y Márquez, 2010.

Figura 5. Plantas de tomillo (Thymus vulgaris L.) sumergidas en la suspensión del biocontrolador. Joya y Márquez, 2010.
Inoculación del patógeno
Una vez transcurridas 24 horas de la inoculación del biocontrolador, con ayuda de una jeringa estéril se inoculó directamente por inyección 1 ml de la suspensión del patógeno a cada uno de los tratamientos y testigos positivos.
Los testigos negativos fueron sumergidos en agua destilada estéril e inoculados con 1 ml de esta solución. Una vez terminada la inoculación y establecimiento de las plantas de 15 días de crecimiento, estas se llevaron al invernadero Nº 8 cama 3 de la Facultad de Agronomía de la Universidad Nacional de Colombia Sede Bogotá, donde permanecieron un mes a una temperatura promedio de 18-20ºC.
Las plantas fueron evaluadas cada cinco días. Se evaluó la presencia de daño (clorosis, pudrición y necrosis) con base a una escala de severidad diseñada, Figura 6. Al finalizar la evaluación las plantas fueron sometidas a un proceso de secado a 170ºC por treinta y seis horas para posteriormente calcular el peso seco total, peso seco parte aérea y peso seco de la raíz.
Pruebas de patogenicidad – Comprobación de postulados de Koch
Se realizó una prueba de patogenicidad para demostrar que el microorganismo aislado, identificado y conservado era el responsable patógeno causante de los síntomas característicos de marchitez vascular en tomillo (7) y probar los postulados de Koch. Para estas pruebas se utilizaron todas las plantas inoculadas anteriormente, se sometieron a desinfección, se lavaron con agua y tween 80 tres veces con el fin de eliminar la mayor cantidad de contaminantes que pudieran tener.
Posteriormente, para la desinfección de muestras se sumergieron los segmentos de tallo de las plántulas en una solución de hipoclorito de sodio al 1% durante un minuto con agitación permanente, pasado este tiempo se sumergieron en etanol al 70% durante treinta segundos con agitación, las muestras fueron lavadas tres veces con agua destilada estéril para eliminar el exceso de desinfectante y luego secadas con papel toalla estéril (10). Luego con una pinza se colocaron sobre el agar PDA, se dejaron incubando a una temperatura de 22ºC durante ocho días. Posteriormente se observó el crecimiento y las características macroscópicas del microorganismo en las cajas con agar PDA, además, se realizó la confirmación del patógeno microscópicamente con ayuda de las claves de identificación FUSKEY (12).

Figura 6. Escala de severidad utilizadas por el Centro Internacional de Agricultura Tropical (CIAT) para marchitez vascular por Fusarium sp., modificada y adaptada para plantas de tomillo por Joya y Márquez. 2010.
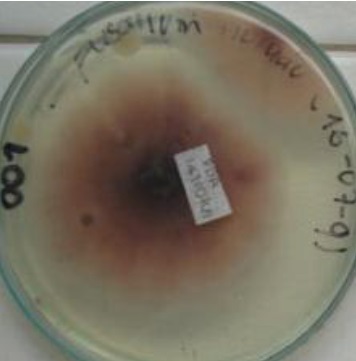
Figura 7. Aislamiento de Fusarium sp., en agar PDA a partir de plantas de tomillo (Thymus vulgaris L.) Joya y Márquez. 2010.
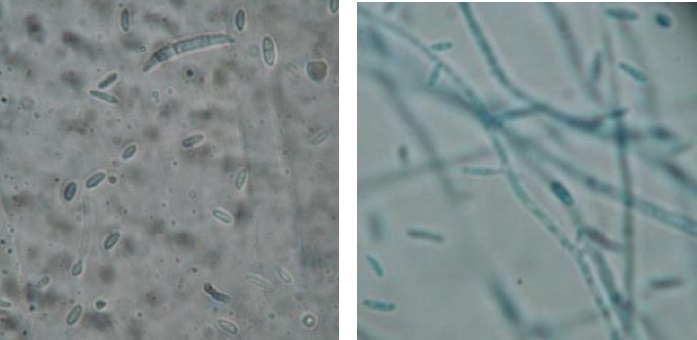
Figura 8. Estructuras microscópicas del aislamiento de Fusarium pseudonygamai (40X). a. Escasas macroconidias con 5 septos. b. Abundantes microconidias con dos septos. Joya y Márquez. 2010.
Las seis bacterias escogidas como posibles biocontroladores se identificaron en la coloración de Gram como bacilos Gram positivos esporulados y pertenecientes al género Bacillus spp. La identificación de los bacilos pro pruebas bioquímicas se presenta en la Tabla 2.
2. Verificación de antagonismo in vitro
Las cepas bacterianas B1y B2 presentaron halos de inhibición del crecimiento del hongo positivos tanto hacia lo ancho como a lo largo, B4 y BR fueron positivas solo hacia los lados (ancho), las bacterias B14 y E2 no presentaron halos y el hongo paso sobre la línea de crecimiento de las bacterias, como se observa en la Figura 9.
Al observar el radio de crecimiento del patógeno frente a las seis cepas evaluadas se observó que las bacterias frente a las cuales el patógeno tuvo los menores radios de crecimiento fueron B1 y B2 para los días quinto y séptimo con respecto al testigo, Figura 10. A diferencia de las bacterias E2 y B14 donde el patógeno mostro los mayores radios de crecimiento a partir del segundo día de evaluación.
Tabla 2. Resultados identificación de los 6 microorganismos.

Figura 9. Pruebas de antagonismo in vitro.E2: Bacillus brevis. BR: Bacillus megaterium. B1: Bacillus
licheniformis. B2: Bacillus subtilis. B14: Bacillus megaterium. B4: Bacillus cereus. Joya y Márquez. 2010.
En los resultados obtenidos del porcentaje de inhibición de las seis cepas evaluadas frente al patógeno, se observó que B2 tuvo el mayor efecto antagonista, ya que desde el tercer día demostró el mayor porcentaje de inhibición con respecto a las otras cepas, logrando mantener al día quinto y séptimo los porcentajes más altos, Figura 11, contrario a lo observado en E2 que mostró los menores porcentajes de inhibición frente al patógeno.
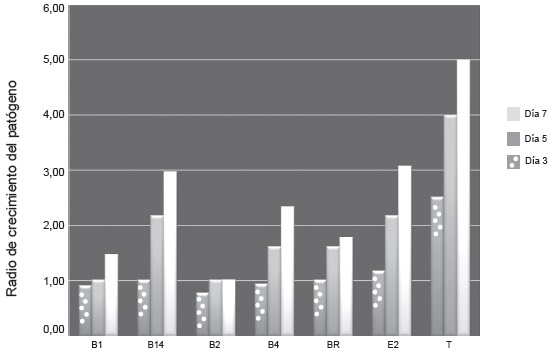
Figura 10. Radio de crecimiento del patógeno frente a los antagonistas “in vitro” a los 3,5 y 7 días. E2: Bacillus brevis. BR: Bacillus megaterium. B1: Bacillus licheniformis. B2: Bacillus subtilis. B14: Bacillus megaterium. B4:Bacillus cereus. T: testigo (Fusarium pseudonygamai).Joya y Márquez. 2010.
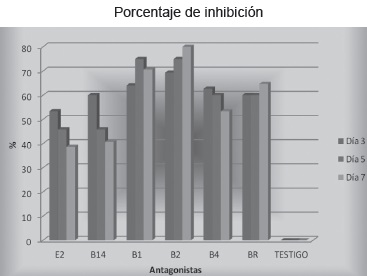
Figura 11. Porcentaje de inhibición de las bacterias frente al patógeno “in vitro” a los 3,5 y 7 días. E2: Bacillus brevis. BR: Bacillus megaterium. B1: Bacillus licheniformis. B2: Bacillus subtilis. B14: Bacillus megaterium. B4: Bacillus cereus. T: testigo (Fusarium pseudonygamai). Joya y Márquez. 2010.
Según los datos obtenidos por la tasa de crecimiento del patógeno frente a las seis cepas a los tres, cinco y siete días, se observó que desde el primer día de evaluación la cepa frente a la cual el patógeno presentó la menor tasa de crecimiento fue B2, Figura 12. Diferente a lo que se observó con E2 y B14 con las cuales el patógeno mostró las mayores tasas de crecimiento.
Se pudo observar que las seis cepas evaluadas mostraron algún tipo de control ya que el patógeno nunca alcanzo igual tasa de crecimiento con respecto al testigo.
3. Pruebas bajo condiciones de invernadero
Teniendo en cuenta que los seis Bacillus spp., mostraron buen comportamientoen las pruebas in vitro se decidió realizar elestudio bajo condiciones de invernaderocon la totalidad de ellos.
Los resultados arrojados por las pruebas bajo condiciones de invernadero mostraron que los tratamientos que se vieron menos afectados por el patógeno al presentar los menores porcentajes de severidad (25%) de la enfermedad con respecto al testigo que alcanzo el 100%, fueron aquellos que estaban inoculados con las bacterias B2 y B14, Figura 13.
El tratamiento inoculado con la bacteria B1 presento el mayor porcentaje de severidad al alcanzar el 75% de la enfermedad con relación a los otros cinco tratamientos, seguido de los tratamientos con las bacterias B4, E2 y BR que se vieron afectados en un 50%, Figura 13. A pesar de que hubo tratamientos que se vieron altamente afectados por la enfermedad, al final de la lectura, ninguno presento el mismo porcentaje de daño que se evidenció en el testigo positivo.
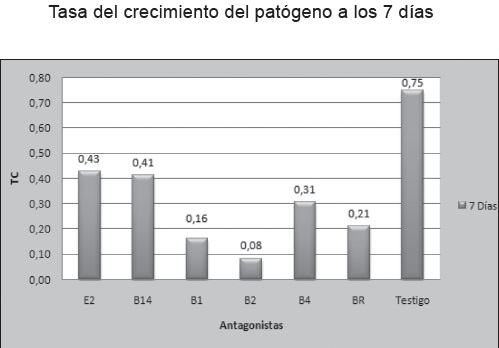
Figura 12. Tasa de crecimiento del patógeno frente a las 6 bacterias a los 7 días. E2: Bacillus brevis. BR: Bacillus megaterium. B1: Bacillus licheniformis. B2: Bacillus subtilis. B14: Bacillus megaterium. B4: Bacillus cereus. T: testigo (Fusarium pseudonygamai). Joya y Márquez. 2010.
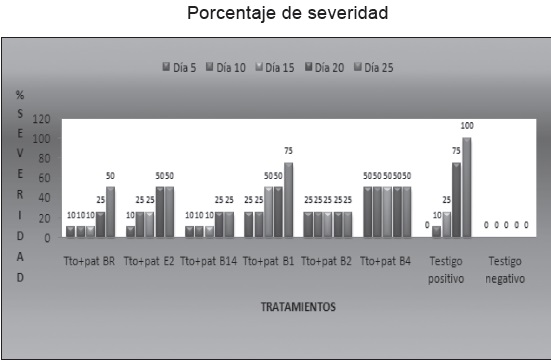
Figura 13. Porcentaje de severidad de los tratamientos. Tto+pat BR: Tratamiento inoculado con el patógeno y la bacteria BR (Bacillus megaterium). Tto+pat E2: Tratamiento inoculado con el patógeno y la bacteria E2 (Bacillus brevis). Tto+pat B14: Tratamiento inoculado con el patógeno y la bacteria B14 (Bacillus megaterium). Tto+pat B1: Tratamiento inoculado con el patógeno y la bacteria B1 (Bacillus licheniformis). Tto+pat B2: Tratamiento inoculado con el patógeno y la bacteria B2 (Bacillus subtilis). Tto+pat B4: Tratamiento inoculado con el patógeno y la bacteria B4 (Bacillus cereus). Testigo positivo: Tratamiento inoculado solo con el patógeno. Testigo negativo: Planta sola sin inocular. Joya y Márquez. 2010.
En cuanto al análisis del número de ramas, longitud de raíz y parte aérea de las plantas al inicio y al final, el análisis estadístico de los datos mostró que no hay diferencias significativas (p>0.05) entre los tratamientos evaluados. Con relación al peso seco de la parte aérea de las plantas tampoco se observaron diferencias significativas, contrario a lo que sucedió con el peso seco de la raíz donde se encontraron diferencias significativas entre tratamientos (p<0.05).
Al comparar los resultados de peso seco de la raíz entre los tratamientos con el patógeno y la bacteria frente al testigo positivo se pudo evidenciar que BR presentó el mayor valor con respecto al testigo, sin embargo no fue significativo. Los tratamientos E2, B14 y B2 demostraron igual comportamiento, al igual que B1 con B4, Figura 14.
Los tratamientos que estaban inoculados con la bacteria, B14 presentaron el mayor resultado en gramos, al igual que E2, BR y B1. B2 y B4 aunque tuvieron menor valor en peso seco en comparación con los demás tratamientos pero fueron superiores al testigo.
4. Pruebas de patogenicidad – Comprobación de postulados de Koch
Las plantas de tomillo sanas inoculadas con el aislamiento de Fusarium pseudonygamai, obtenido en la primera fase del estudio, mostraron síntomas característicos de marchitez vascular. Se observó que los vasos conductores de nutrientes se encontraban bloqueados, Figura 15, como primer síntoma de la enfermedad.
El control negativo no presentó ninguno de los síntomas típicos de la enfermedad, Figura 15. Se probaron los postulados de Koch.
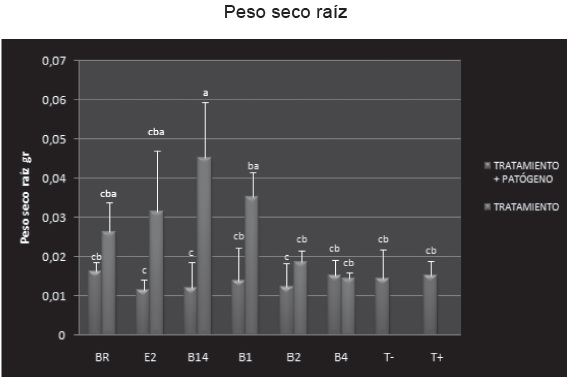
Figura 14. Peso seco raíz de los tratamientos y testigos. Barras azules: tratamientos inoculados con el patógeno y las 6 bacterias. Barras rojas: tratamientos inoculados solo con las 6 bacterias. T +: planta inoculada solo con el patógeno. T -: planta sin inocular. Joya y Márquez. 2010.
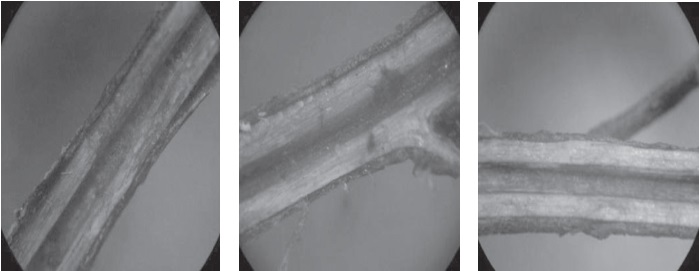
Figura 15. Corte longitudinal segmento de tallos de plantas de tomillo con decoloración vascular a los 8 días de inoculación con el patógeno vistas al estereoscopio. a. Testigo positivo A. b. Testigo positivo B. .c Testigo positivo C. Joya y Márquez. 2010.

Figura 16. a. Control negativo pruebas de patogenicidad. b. Corte del tallo visto al estereoscopio. c. Cultivo PDA segmento de tallo Joya y Márquez. 2010.
De acuerdo con los resultados en las pruebas in vitro Bacillus subtilis es el microorganismo más efectivo frente al patógeno aislado corroborando lo que han reportado otros estudios donde tiene efecto antagónico frente a Fusarium sp., a través de la liberación de compuestos con propiedades antifúngicas como la subtilina y otros antibióticos de la familia de las Iturinas, polipéptidos que actúan sobre la pared celular de los hongos (18).
El comportamiento similar de Bacillus licheniformis con respecto a Bacillus subtilis sepodría deber a la propiedad biofungicidaque ha reportado Garcia L, et al, 2004(19). Aunque Bacillus subtilis mostró los mejoresresultados in vitro frente al patógeno,también las demás cepas ejercieronalgún tipo de antagonismo si se comparala tasa de crecimiento y porcentaje de inhibicióncon respecto al testigo las cualesnunca fueron superiores. Teniendo encuenta que estas bacterias identificadascomo Bacillus cereus, B. licheniformis y B. megaterium han sido reportadas como microorganismosbiocontroladores por la producciónde antibióticos no es de extrañareste comportamiento (19).
Bajo condiciones de invernadero se logró comprobar lo observado en las pruebas in vitro, es decir que las plantas inoculadas con la bacteria B2 (Bacillus subilis) mostraron al final el menor porcentaje de severidad de la enfermedad. Por otra parte, aunque B1 (Bacillus licheniformis) tuvo un efecto antagónico in vitro similar a B2, bajo condiciones de invernadero presentó el mayor porcentaje de severidad de la enfermedad lo cual podría ser explicado a que no todos los comportamientos in vitro son iguales a los expresados en condiciones in vivo, en este caso, bajo condiciones de invernadero. El efecto biocontrolador de B1 ha sido reportado sobre enfermedades tipo manchas foliares y tizón que no son enfermedades producidas por Fusarium, pero no hay resultados que indiquen que es biocontrolador del hongo que produce la marchitez vascular (19).
El bajo porcentaje de severidad presentado en las plantas de tomillo inoculadas con la bacteria B2 (Bacillus subtilis), evidencia que este bacilo puede estar produciendo sustancias antibióticas específicas y que se ha adaptado a su medio ambiente en términos del genotipo de la planta y el clima como lo menciona Roesti D, et al, 2006 (20). Además, de acuerdo con Maldonado E, et al, 2008 (21) las bacterias como Bacillus subtilis hacen parte de uno de los diversos gruposde microorganismos asociados a lasplantas con potencial de inducir mecanismode defensa a través del desarrollode una respuesta sistémica Inducida.
De la misma forma, de acuerdo a los resultados de severidad no tan altos presentados por los tratamientos con respecto al testigo positivo, se puede deducir que todas las bacterias ejercieron un efecto biocontrolador contra el patógeno ya que los síntomas tardaron en manifestarse en comparación con otros estudios donde a los ocho días de inoculado Fusarium sp., estos se hacían evidentes y las plantas morían después de pocos días (22).
Con relación a los resultados de peso seco en donde no se encontraron diferencias significativas en la parte aérea pero si en la raíz, se puede deber primero a que las bacterias del genero Bacillus spp., han sido ampliamente reportadas en la literatura como promotoras de crecimiento vegetal al estimular el desarrollo de las raíces de las plantas (23) ó como Bacillus subtilis al ejercer un efecto biocontrolador de patógenos del suelo (24), segundo a la forma como se desarrolla la enfermedad, es decir, que a través de heridas artificiales provocadas en la base del tallo en los tratamientos con la bacteria y el patógeno se facilitó la entrada del hongo a la planta a partir de este punto y no desde la raíz como puede suceder en condiciones naturales, afectando de esta forma el paso de nutrientes por el bloqueo de los vasos conductores produciendo así su acumulación en el sistema radical.
Las razones por las que BR (Bacillus megaterium) haya presentado el mejor resultado en peso seco de raíz, seguido por el tratamiento con B14 (Bacillus megaterium), tratamiento que además presentó un menor porcentaje de severidad de la enfermedad y al ser inoculado solo mostró el mayor rendimiento en peso seco con respecto al testigo, se puede deber a que las comunidades microbianas de la rizosfera contribuyen al crecimiento de las plantas a través del reciclaje y disponibilidad de nutrientes y al aumento de la salud de las raíces por competencia con los patógenos del suelo (20). Teniendo en cuenta lo anterior y como lo reporta Anthony O, et al, 2009 (25) el efecto protector y el aumento en peso seco de raíz de las plantas inoculadas con Bacillus megaterium se debe a que es un microorganismo solubilizador de fosfato que aumenta la asimilación de fosforo, el crecimiento y por tanto la salud de la planta (26-27). Se puede concluir que el género Bacillus es potencialmente un microorganismo que le brinda protección a la planta y funcionalmente podría considerarse un controlador biológico porque produce sustancias antibióticas, solubilizador de fosfato porque facilita a la planta la disponibilidad de nutrientes o porque ejerce funciones como sideróforo. Cualquiera que sea la función que ejerza es positiva y por lo tanto este género es promisorio y debe ser investigado por especie para determinar genéticamente su funcionalidad, así como conocer su cinética para finalmente obtener productos promisorios para la agricultura.
2. Gamba Y, Barrientos J, Cuervo J. Manejo agronómico y postcosecha de hierbas aromáticas culinarias. Proyecto hierbas aromáticas, curso de extensión. Universidad nacional de Colombia, sede Bogotá; 2007.
3. Berzins M, Romagnoli S. Cultivo de plantas aromáticas. Fruticultura y Diversificación. Argentina; 2004.
4. Latorre B. Enfermedades de las plantas cultivadas. Edición 5ª. Editor Alfaomega, 1999.
5. Tovar J. Evaluación de la capacidad antagonista “in vivo” de aislamientos de Trichoderma spp., frente al hongo fitopatógeno Rhizoctonia solani. [Trabajo de grado]. Colombia, Pontificia Universidad Javeriana; 2008.
6. Cook RJ, Baker KF. The Nature and Practice of Biological Control of Plant Pathogens. American Phytopathological Society Press. St. Paul, MN, EEUU; 1983
7. Fernández O, Vega L. Microorganismos antagonistas para el control fitosanitario. Manejo Integrado de Plagas. Costa Rica; 2001.
8. Sánchez L. Corrales L. Evaluación de la congelación para conservación de especies autóctonas bacterianas. Programa de Bacteriología y Laboratorio Clínico, Facultad Ciencias de la Salud, Universidad Colegio Mayor de Cundinamarca. Bogotá, Colombia; 2005.
9. Estupiñán H. Ossa J. Efecto del agente causal de la marchitez vascular de la uchuva (Physalis peruviana.) el hongo Fusarium oxysporum SCHLECHT, sobre algunas solanáceas y otras especies cultivadas afectadas por formas especiales del microorganismo. Tesis. Trabajo de grado para optar el titulo Microbiólogo Agrícola y Veterinario. Pontificia Universidad Javeriana. Bogotá; 2007.
10. Duarte S. Pruebas de patogenicidad in vitro con microorganismos aislados de palmas afectadas por marchitez letal. Trabajo de grado presentado como requisito para optar el título de Microbióloga Agrícola y Veterinaria. Pontificia Universidad Javeriana. Bogotá; 2007.
11. Peláez D. Jiménez A. Aislamiento e identificación de hongos fitopatógenos que afectan algunos cultivos de importancia económica en Bolivia. Instituto de Investigaciones Fármaco Bioquímicas. Universidad Mayor de San Andres. La Paz, Bolivia; 2001.
12. Seifert K. Fusarium interactive key. Agriculture and agri-food Canada. [Sitio en internet]. Consultado: 20/09/2009 Disponible en: http://www.ctu.edu.vn/colleges/agri/gtrinh/fuskey.pdf
13. IBUN Instituto de Biotecnología de la Universidad Nacional de Colombia. Protocolo antagonismos in vitro de Pseudomonas fluorescens contra Rhizoctonia solani. Universidad Nacional de Colombia; 2007.
14. Benítez S, Bentley J, Bustamante P, Sánchez L, Corrales L. Aislamiento de los microorganismos cultivables de la rizosfera de Ornithogalum umbellatum y evaluación del posible efecto biocontrolador en dos patógenos del suelo. NOVA. (Bogotá-Colombia); 2007;5: 101-212.
15. Chaves N. Utilización de bacterias y hongos endofíticos para el control biológico del nematodo barrenador Radopholus similis (Cobb) Thorn. Tesis de maestría. Como requisito para optar por el grado de: Magister Scientiae en Agricultura Ecológica. Turrialba, Costa Rica; 2007.
16. Morales I, Rodríguez M, Morales Y et. al. Biodiversity of Fusarium species in Mexico associated with ear rot in maize, and their identification using a phylogenetic approach. Mycopathologia. México; 2007.
17. González R, Montealegre J, Herrera R. Control Biológico de Fusarium solani en Tomate Mediante el Empleo de los Bioantagonistas Paenibacillus lentimorbus y Trichoderma spp. Cien. Inv. Agr.( Santiago Chile); 2004;31(1): 21-28;
18. Fernandez O. Microorganismos antagonistas para el control fitosanitario. Manejo Integrado de Plagas Costa Rica No. 62 p . 9 6 - 1 0 0; 2 0 0 1.
19. Guillen, R. Bacillus spp. Como biocontrol em um suelo infestado com Fusarium spp., Rhizoctonia solani y Phytophthora capsici y su efecto en el desarrollo y rendimiento del cultivo de Chile. Revista mexicana de fitopatología. Ciudad Obregon, México. [Sitio en internet]. Consultado: 05/06/2010. Disponible en: http://redalyc.uaemex.mx/pdf/612/61224204.pdf
20. Roesti D, Gaur R, Johri B, Imfeld G, Sharma, et al. Plant growth stage, fertilizer management and bio-inoculation of arbuscular mycorrhizal fungi and plant growth promoting rhizobacteria affect the rhizobacterial community structure in rain-fed wheat fields. Soil Biology & Biochemistry. (India); 2006; 38: 1111-1120.
21. Maldonado E, Ochoa D, Tlapal B. Efecto del ácido acetil salicílico y Bacillus subtilis en la infección causada por Cucumber mosaic virus en calabacita. Revista Chapingo. Serie horticultura,(México); 2008;14(1): 55-59.
22. Martínez G, Albarracín N, Arcia A. Pudrición basal del ajo causado por Fusarium oxysporum. Agronomía Tropical; 1995;46(3):265-273;.
23. Raggio M, Mora N. Potencial antifúngico de cepas de Bacillus spp. y extracto de Larrea tridentata contra Rhizoctonia solani en el cultivo de la papa (Solanum tuberosum L.). Revista Internacional de Botánica experimental. (Argentina); 2008;77: 241-252.
24. Puente M, García J, Rubio E, Perticari A. Microorganismos promotores del crecimiento vegetal empleados como inoculantes en trigo. INTA – Estación Experimental Agropecuaria Rafaela. Publicación Miscelánea Nº 116. 2010
25. Anthony O, Joseph W, Kloepper. Plant–microbes interactions in enhanced fertilizer-use efficiency. Appl Microbiol Biotechnol. 2009:(85):1–12.
26. Zaidi A, Khan M, Ahemad M, Oves M, Wani P.A. Recent Advances in Plant Growth Promotion by Phosphate-Solubilizing Chapter 2.In: Microbes Microbial Strategies for crop improvement. Springer. 2009.
27. Paredes Mendoza M, Espinosa Victoria D. ácidos orgánicos producidos por rizobacterias que solubilizan fosfato: una revisión crítica. Terra Latinoamericana. 2010:(28);1.