Janeth Navarrete1 M.Sc, Gladys Pinilla1 M.Sc, Liliana Muñoz L1 M.Sc, Ariel Ruiz A2 MD.
1Universidad Colegio Mayor de Cundinamarca
2Universidad Nacional de Colombia
Correspondencia: jeanavilla@gmail.com
Recibido: 17-05-2012 Aceptado: 15-06-2012
El valor de referencia usando la misma técnica para adultos es: índice de fagocitosis 2.7 (2.03-3.92) y porcentaje de muerte intracelular 31.31% (21-39%) .
Palabras clave: fagocitosis, neonatos, polimorfonuclear neutrófilo, muerte intracelular.
Phagocytosis in neonates: determination of normal values for the micro technique phagocytosis and intracellular death of Candida Albicans
Protect the host against strange agents is the main function of the immune system. Thus the innate immunity is the first line of defensemainly through physical and chemical barriers, and the phagocytosis mediated by the polymorphonuclear neutrophils (PMN). The neonates are considered immunologically immature, which makes them more susceptible to pathogenic microorganism.
One of the variations that seem to increment the risk of bacterial infections is the abnormality of the phagocytic system, which can lead to a deficiency in the ability of the PMN to phagocytose and kill microorganisms. Therefore, the objective of this study is to determine the reference value of the micro-technique of phagocytosis and intracellular death of Candida albicans, is a simple and effective technique that can be used to evaluate the phagocytic function since asses the phagocytic index of each PMN and percentage of intracellular death of phagocytized Candida. We analyzed cord blood samples from fifty one healthy neonates.The index of phagocytosis found was 2.64 (SD 0.51) (1.71 to 3.77) and median of percentage of intracellular death was 20% with P25 (18%), P75
(23%), ( 13 to 38%). The reference value using the same technique for adults are: phagocytosis index 2.7 (2.03-3.92) and percentage of intracellular death 31.31% (21-39%).
Key words: phagocytosis, neonates, polymorph nuclear neutrophil and intracellular death
En la inmunidad innata intervienen como primera línea de defensa, las barreras físicas y químicas tales como el epitelio y las sustancias antimicrobianas (producidas en las superficies epiteliales), las proteínas plasmáticas, que incluyen moléculas del sistema del complemento, proteínas de fase aguda y otros mediadores de la inflamación (2).
La fagocitosis, componente celular de la inmunidad innata, constituye la segunda línea de defensa y es el proceso mediante el cual los fagocitos como los Polimorfonucleares Neutrófilos (PMN) y los macrófagos (M), engloban partículas o gérmenes y las ubican dentro de su citoplasma en vacuolas llamadas fagosomas con el fin de destruirlas (3).
En la fagocitosis las células fagocíticas buscan, identifican y llevan al interior de su citoplasma partículas extrañas, estas células poseen en sus membranas receptores para el componente C3b del sistema de complemento, así como para la región constante de la inmunoglobulina G (IgG), lo que permite que los microorganismos opsonizados por éstas moléculas puedan adherirse a la superficie de estas células, facilitando el proceso de fagocitosis, (4).
La fagocitosis es un proceso de dos pasos que son: la fijación y la ingesta de la partícula fagocitada, pero también está compuesto por varias etapas secuenciales que comprenden la quimiotaxis, la adhesión, la endocitosis, y los cambios físicoquímicos intracelulares que habilitan a los fagocitos para endocitar, matar y digerir a los microorganismos. Estos cambios concluyen en la formación del fagosoma, la interacción de éste con endosomas y lisosomas para formar el fagosoma maduro (fagolisosoma), la acidificación del fagolisosoma, la formación de metabolitos reactivos del oxígeno y del nitrógeno, la activación de las hidrolasas lisosomales, y finalmente la expulsión del material de desecho mediante el proceso de la exocitosis (5).
Posteriormente, el proceso finaliza con el “estallido metabólico” en el que los fagocitos que ya tienen partículas en su interior convierten el oxígeno molecular en otros radicales de oxigeno que actúan sobre el germen y lo destruyen. Durante el proceso se produce incremento del consumo de oxígeno, radical superóxido, producción de peróxido de hidrógeno (H2O2) entre otros metabolitos que resultan altamente tóxicos para el germen (6).
En el neonato se ha documentado la inmadurez en la funcionalidad de su sistema inmune celular y humoral, factor que incrementa la susceptibilidad a las infecciones. Con relación a los fagocitos del neonato se han observado deficiencias en varios aspectos como en la migración, rigidez en su membrana, baja producción de moléculas de adhesión y menor actividad microbicida (7).
Por lo todo lo anterior, el objetivo del presente trabajo fue proporcionar valores de referencia para la funcionalidad del PMN de neonatos sanos analizada mediante la micro técnica de fagocitosis y muerte intracelular de Cándida (4).
Muestra:Las muestras de sangre de cordón fueron recolectadas en tubos falcon estériles con heparina (1 U/ml de sangre). Se esperó un tiempo máximo de dos horas a temperatura ambiente hasta el momento de procesamiento.
Obtención de polimorfonucleares:se realizó un hemograma de la muestra total. Posteriormente se centrifugó a 1800 rpm por 10 minutos para separar el plasma rico en leucocitos. Se mezcló con dextran (6% en PBS) en una proporción de 3ml de dextrán por cada 10ml de sangre. La sedimentación se realizó a 37°C durante 30 minutos en un ángulo de 45° de inclinación y posteriormente en un ángulo a 90° por 30 minutos a 37°C. Se separó el plasma y centrifugó a 2000 rpm por 5 minutos. El sobrenadante se descartó para re suspender en 1ml de solución de Hank’s, mezclando suavemente, se agregaron de 3 a 5 gotas de esta suspensión con PMN en aros de 5-8 mm de diámetro adheridos a una laminilla de vidrio.
Adherencia de las células al vidrio:Las laminillas con los PMN se incubaron 1 hora a 37°C, posteriormente se lavó con solución de Hank’s (pH 7.2) precalentada a 37°C. Cada muestra se procesó por duplicado.
Solución de Cándida Albicans:de un cultivo no mayor de 24 horas de Cándida albicans en agar Saboreaud se tomó una alícuota, la cual fue lavada tres veces con solución de Hank´s precalentada a 37°C, para obtener una concentración final de 2 x 106UFC/ml de cándida.
Pool de opsoninas:como fuente de opsoninas (complemento e inmunoglobulinas) se usó un pool de sueros de personas normales que fue separado en alicuotas y conservado a -80°C hasta el momento de su uso.
Microtécnica de fagocitosis y muerte intracelular de Cándida:Las células adheridas al vidriofueron incubadas a 37°C durante 10 minutosen cámara húmeda con 120 L de lasolución de Cándida Albicans y 50 L del poolde opsoninas. Posteriormente, las laminillasfueron lavadas 2 veces con soluciónde buffer Hank´s, previamente precalentadaa 37°C; adicionalmente, para evitarla desecación, se adicionaron 200 L delbuffer a las células adheridas e incubadasen cámara húmeda a 37°C durante 40 minutos.
Finalmente, la tinción de células vivas y muertas se llevó a cabo adicionando 50 L de solución de azul de metileno (1m en solución de Hank´s) e incubado por 10 minutos a 37°C en cámara húmeda. La lectura se realizó en microscopio de luz, contando 100 PMN con el número total de cándidas fagocitadas. El índice de fagocitosis se calcula teniendo en cuenta el número de cándidas que fagocitó un PMN.
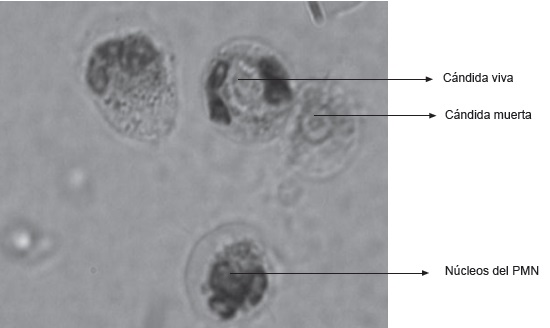
Para la muerte intracelular de cándida, el porcentaje es calculado teniendo en cuenta del total de cándidas fagocitadas, cuantas captaron el colorante (cándidas muertas), Figura 1.
Análisis estadístico:las variables categóricas se describen como porcentajes. La distribución de las variables continuas se analizó usando la prueba de Shapiro-Wilk. Los datos se presentan como medias y desviaciones estándar o medianas y percentiles según sea apropiado de acuerdo con su distribución. Se aplicó la prueba de t-student para comparación de medias y se obtuvieron gráficas de dispersión e índices de correlación de variables continuas.
El análisis estadístico se realizó usando el programa STATA 8.0.
Aspectos éticos:el protocolo fue aprobado por el comité de ética de la Universidad Colegio Mayor de Cundinamarca y todos los sujetos aceptaron y firmaron el consentimiento informado.

Figura 1. Tinción con Azul de Metileno de PMN que han fagocitado Cándidas
Los valores de referencia encontrados para la micro-técnica de fagocitosis y muerte intracelular de Cándida en neonatos sanos se presentan en la Tabla 2.
Tabla 1. Características anatómicas y hematológicas del recién nacido sano.
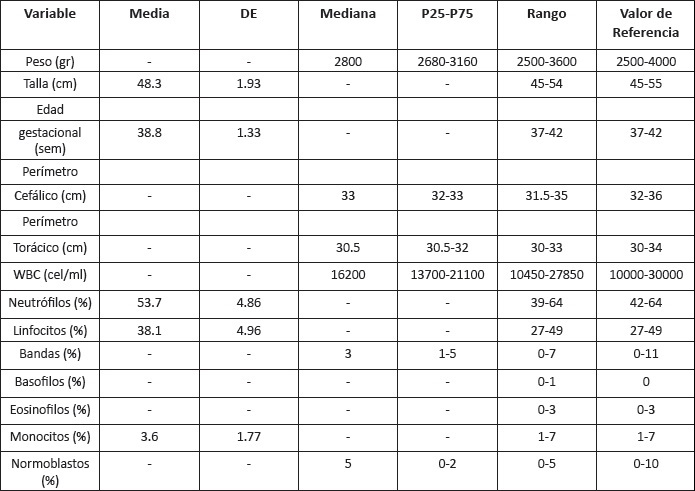
Tabla 2. Valores de referencia en PMN de neonatos para la micro técnica de fagocitosis y muerte intracelular de Cándida
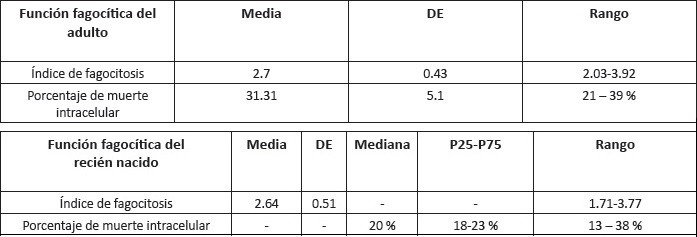
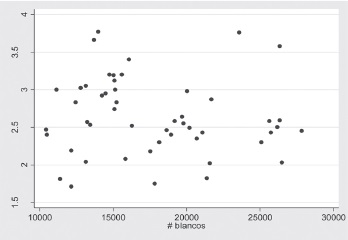
Figura 2. Correlación entre el índice de fagocitosis y el número de leucocitos
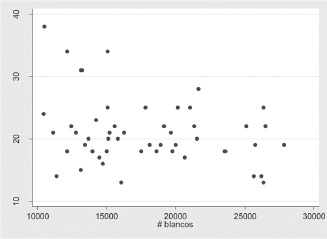
Figura 3. Correlación entre el porcentaje de muerte intracelular y el número de leucocitos
De esta forma, no se encontraron diferencias estadísticamente significativas en el índice de fagocitosis y el género del neonato (p=0.557). (t de student), como entre el porcentaje de muerte intracelular y género (p=0.8204) (prueba de Wilkxon). Así mismo, no se observó correlación entre el recuento de leucocitos y el índice de fagocitosis, Figura 2. Se determinó baja correlación y de signo negativo entre el recuento de leucocitos y el porcentaje de muerte intracelular, es decir hay mayor porcentaje de muerte intracelular en las muestras que evidenciaban menos conteo de leucocitos, Figura 3.
Así mismo, no se observó correlación entre la función fagocítica y el número de PMN y se determinó baja correlación y de signo negativo entre el índice de fagocitosis y el porcentaje de muerte, es decir que a medida que aumenta el porcentaje de muerte hay una caída leve del índice de fagocitosis Figura 4.
La determinación de los valores de referencia de fagocitosis en recién nacidos surge de la necesidad de evaluación de uno de los factores del sistema inmune de los neonatos, debido a que es una población vulnerable a cualquier tipo de infección, pues su organismo aún no es lo suficientemente maduro, en comparación con los adultos para responder al ataque de microorganismos invasores.
En este estudio, los valores de referencia encontrados en neonatos y comparados con el adulto, evidencian que no hay diferencias significativas entre los valores del índice de fagocitosis, es decir los PMN de ambas poblaciones están funcionalmente homogéneas en el proceso de ingestión.
Sin embargo, con relación a la función de muerte intracelular, se observó una diferencia en la media, en neonato es de 20% mientras que en el adulto es de 31,31% lo que evidencia deficiencias en los PMN del neonato en los procesos intracelulares para producir la muerte del microorganismo.
Estudios han observado que hay deficiencias en la generación del estallido respiratorio permite una mayor susceptibilidad de los recién nacidos prematuros.
La respuesta inmune en el neonato es semejante a un estado de inmunodeficiencia que predispone al prematuro y al recién nacido a término a ser susceptible a infecciones tan graves como la sepsis (9, 10).
Se han encontrado defectos cualitativos y cuantitativos en la fagocitosis debido principalmente a la inmadurez de su sisto de leucocitos 12 a 24 horas de nacido es de 18,482 +/-6,600 leucocitos/L, la cual gradualmente disminuye a 9,817 +/- 2,496/L, durante catorce a treinta días después (13).
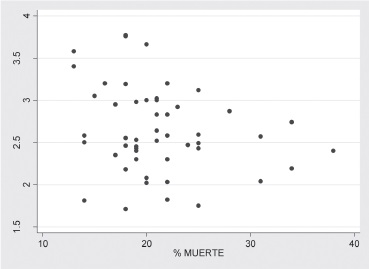
Figura 4. Correlación entre el índice de fagocitosis y el porcentaje de muerte intracelular
La técnica utilizada para valorar la función fagocítica por sus características propias de fácil montaje, no requiere de infraestructuras de laboratorio de alta tecnología, permite valorar esta función tan importante en los recién nacidos, población altamente susceptible de contraer infecciones. Por el tipo de población a analizar la muestra a analizar fue sangre de cordón. Sin embargo, al requerir el análisis de la fagocitosis de un neonato, para esta técnica se usan sólo tres gotas de sangre periférica que se adhieren a la laminilla para continuar con el mismo proceso, cualidad que favorece aun más el uso de esta técnica para valorar la función fagocítica (4).
En conclusión, consideramos que la microtécnica de fagocitosis y muerte intracelular de Cándida es una herramienta diagnóstica altamente reproducible para evaluar el funcionamiento del sistema fagocítico del recién nacido.
2. Miguel A. Hernández-Urzúa, Anabell Alvarado- Navarro. Interleucinas e inmunidad innata. Rev Biomed. 2001; Vol. 12 /No. 4.: 12:272-280.
3. Rojas O, Arce P. Fagocitosis: mecanismos y consecuencias. Primera parte. Bioquimia. 2003; 28: 19-28.
4. Navarrete J, Pinilla G, Muñoz L, Ruiz A, Cifuentes Y. Determinación de valores de referencia para la microtécnica de fagocitosis y muerte intracelular de Cándida álbicans en un grupo de población sana en Bogotá. NOVA. 2007; 7:1-7.
5. Rojas O, Arce P. Fagocitosis: mecanismos y consecuencias segunda parte. Bioquimia. 2004; 29:18-31.
6. Rojas O. Arce P. Fagocitosis: mecanismos y consecuencias tercera parte. Bioquimia. 2004; 29:55-67.
7. Penagos M, Berrón R, García M, Zaragoza J. El sistema inmune del recién nacido. Alergia, Asma e Inmunología Pediátrica. 2003; 12:63-68.
8. Petrova A, Mehta R. Dysfunction of innate immunity and associated pathology in neonates. Indian J Pediatr. 2007;74:185-91.
9. Currie AJ, Curtis S, Strunk T, Riley K, Liyanage K, Prescott S, Doherty D, Simmer K, Richmond P, Burgner D. Preterm infants have deficient monocyte and lymphocyte cytokine responses to group B streptococcus. Infect Immun. 2011; 79:1588-96.
10. Raimondi F, Ferrara T, Maffucci R, Milite P, Del Buono D, Santoro P, Grimaldi LC. Neonatal sepsis: a difficult diagnostic challenge. Clin Biochem. 2011;44:463-4.
11. Cairo MS. Neonatal neutrophil host defense. Prospects for immunologic enhancement during neonatal sepsis. Am J Dis Child. 1989;143:40-6.
12. Destin K, Linden J, Laforce-Nesbitt S, Bliss J. Oxidative burst and phagocytosis of neonatal neutrophils confronting Candida albicans and Candida parapsilosis. Early Hum Dev. 2009;85:531-53.
13. Sasanakul W, Singalavanija S, Hathirat P, Mahaphan W, Chuansumrit A . Hemogram in normal newborn babies with special reference to platelet count Southeast Asian J Trop Med Public Health. 1993; Suppl 1:237-40.