Identificación microbiológica de marchitez vascular en col china (Brassica campestris L. var pekinensis) en Cogua, Colombia
Ligia Sánchez1, Yesid Ariza1, Estefania Castañeda1, Edgar Martinez2
1Universidad Colegio Mayor de Cundinamarca, Bogotá, Colombia
2Universidad de Ciencias Aplicadas y Ambientales, Bogotá, Colombia
Correspondencia: ligiasanchezle@gmail.com
Recibido: 25-08-10/ Aceptado: 27-11-10
La col china (Brassica campestris L. var pekinensis) es una hortaliza de origen asiático apreciada en todos los continentes por su valor nutricional y propiedades medicinales. Reportes de productores de todo el país han manifestado que hay pérdidas económicas en este cultivo al parecer originadas por enfermedades bacterianas; una de ellas es la marchitez bacteriana, que disminuye el tiempo de viabilidad del producto, también su continuidad en el mercado y, en consecuencia, la no utilización del mismo por parte del consumidor. Cultivadores en Cogua, Colombia reportan pérdidas de un 80% en su producción a causa de esta patología. La principal manifestación es la presencia de lesiones húmedas y marchitez en los bordes externos de las hojas.
El objetivo de este proyecto fue la identificación microbiológica de los posibles patógenos de la marchitez bacteriana en un cultivo de col china en Cogua, Colombia. La metodología utilizada incluyó el análisis de los microorganismos presentes en plantas sanas y enfermas, el aislamiento de bacterias de las lesiones vasculares, la elaboración de pruebas de patogenicidad y la identificación fenotípica del patógeno. Los resultados permitieron concluir que el microorganismo patógeno que ocasionaba marchitez bacteriana en los cultivos de col china en Cogua, Colombia era Xanthomonas axonopodis. La identificación de patógenos en plantas de interés económico permite tomar medidas más eficientes referentes a las buenas prácticas agrícolas para manejar enfermedades en plantas y disminuir las pérdidas de producción.
Palabras clave: col china, flavonoides, fitopatología, marchitez vascular, Xanthomonas.
Microbiological identification of vascular wilt in Chinese cabbage (Brassica campestris L. var pekinensis) in Cogua, Colombia
Chinese cabbage (Brassica campestris L. var pekinensis) is an Asian vegetable appreciated in all continents for its nutritional value and medicinal properties. Reports from farmers across the country have shown that there are economic losses in this crop apparently caused by bacterial diseases, one of which is bacterial wilt, which decreases the time of viability of the product also its continuity in the market and therefore, non-use by the consumer. Growers in Cogua, Colombia reported an 80% loss in production due to this disease. The main symptom is the presence of moist lesions and wilting on the outer edges of the leaves. The objective of this project was the identification of potential microbiological pathogens of bacterial wilt in a Chinese cabbage crop in Cogua, Colombia. The methodology included the analysis of microorganisms in healthy and diseased plants, isolation of bacteria in the vascular lesions, the development of pathogenicity and phenotypic identification of the pathogen. The results concluded that the pathogen that caused bacterial wilt on crops of Chinese cabbage in Cogua, Colombia was Xanthomonas axonopodis. The identification of pathogens in plants of economic interest can take more effective measures relating to good agricultural practices to manage diseases in plants and reduce production losses.
Keywords: Chinese cabbage, flavonoids, plant pathology, vascular wilt, Xanthomonas.
La col china, originaria del Norte de China (4) es una de las especies promisorias en Colombia, se adapta muy bien al clima frio, se desarrolla en optimas condiciones en suelos ricos en nitrogeno y potasio, humedad y temperatura que favorecen la floración temprana (5). Se ha indicado que un alto consumo de los productos de la planta estan asociados a la disminucion de enfermedades cronicas, como las cardiovasculares, la diabetes y el cancer (6-8), debido a la presencia de antioxidantes, vitamina C, vitamina E, carotenoides, glucosinolatos y compuestos fenolicos, especialmente flavonoides que en años recientes, ha contribuido a mejorar la calidad de vida del ser humano.
En Colombia, la demanda del producto corresponde a estratos medios y altos; destino actual de este producto son supermercados de cadena y su comercializacion es relativamente rapida. El Ministerio de Agricultura y Desarrollo Rural ha estimulado la participacion de productores de hortalizas en los ultimos anos consolidando un acuerdo de competitividad (9). En este documento se reporta que el mercado de coles y coliflores es bajo, pero tambien que los productores de la región cundiboyacense, por la demanda de los consumidores, han aumentado su produccion progresivamente en los ultimos cinco años.
El mayor problema del cultivo de coles mundialmente, es la marchitez vascular producida por bacterias (10-12), en el caso concreto de la col china, es un grave problema, pues son las hojas el producto consumible de este vegetal. Trabajos previos en otros paises han identificado que Xanthomonas es el genero bacteriano mas asociado a la pudricion de las cruciferas (5). El mecanismo de patogenicidad de Xanthomonas parece estar asociado al sistema de secrecion tipo III (13-15), que es propio de las bacterias Gram negativas y que parece estar relacionado con respuestas especificas gen por gen entre las plantas y los bacilos Gram negativos lo que podria explicar porque las plantas son atacadas casi exclusivamente por bacilos Gram negativos tipo Pseudomonas, Xanthomonas y Erwinia, entre otros
(16,17).
Se sabe tambien que en el caso particular de Xanthomonas se produce un pigmento amarillo conocido como xanthomonadina, que es un componente quimico taxonomico que facilita su diagnostico y le confiere proteccion contra los daños foto-biologicos; tambien es indicador de patogenicidad (18). Se ha determinado la presencia de una feromona en esta especie que es necesaria para la producción de su polisacarido extracelular (EPS) y de sus dos tipos de pigmentos (pig A y pig G) , indispensable para la supervivencia en el huesped y que juegan un papel determinante en la infeccion del hospedero y/o supervivencia en la planta (19-21).
Los productores del municipio de Cogua, en la sabana de Bogota, han reportado perdidas debidas a una enfermedad que se caracteriza por lesiones que son comparables con las reportadas para infecciones bacterianas por Xanthomonas en algunas variedades de hortalizas. La mayoria de las investigaciones en el pais se han orientado al diagnostico y control de patologias producidas por hongos, comunes en otras variedades vegetales y por lo tanto no hay un modelo de diagnostico y control de patologias bacterianas que permita implementar medidas de control eficaces que mitiguen las perdidas economicas por esta enfermedad bacteriana.
Con este trabajo se espera hacer un aporte sobre el conocimiento del tipo de microorganismo bacteriano que esta causando marchitez vascular en los cultivos de col china en Cogua, municipio de Cundinamarca, Colombia, para controlar su diseminacion, tomar medidas de control eficientes en lo que se refiere a buenas practicas agricolas (BPA), a dar apropiado uso a los plaguicidas y a buscar alternativas de control fitoquimico o biologico frente a la enfermedad, y de esta manera conservar las caracteristicas del producto consumible, sin alterar el equilibrio natural del medio en que se desarrollan, mejorando la calidad y eficiencia del cultivo, lograr mayor rentabilidad economica, un producto mas acorde con las exigencias del mercado y disminuir la incidencia de la enfermedad en el territorio nacional.
Fase 1. Aislamiento e identificación microbiológica
Toma de muestras: se seleccionaron 10 plantas enfermas y 10 sanas de los cultivos de col china (Brassica campestris sbp pekinensis) procedentes de Cogua, Cundinamarca, utilizando un muestreo aleatorio simple haciendo un cubrimiento de todo el terreno. Las muestras se envolvieron en hojas de papel y se protegieron con bolsas de polietileno y se transportaron para el análisis correspondiente antes de una hora.
Procesamiento de las muestras: se procedio a detectar la presencia bacteriana segun el protocolo de Mendoza y Castano (21). 1. Lavar las muestras de col china, sanas y enfermas con agua corriente durante varios minutos a fin de eliminar contaminantes. 2. Seleccionar las hojas mas afectadas de las plantas enfermas y las hojas de las plantas sanas. 3. Hacer un corte fino de 1mm2 del tejido mas proximo al area necrosada. 4. Realizar un montaje humedo y observar al microscopio la salida del flujo bacterial del tejido vegetal afectado para comprobar la presencia de microorganismos bacterianos. 5. Aislar y purificar las bacterias obtenidas.
Aislamiento y purificación de bacterias:
1. Realizar un corte del area aproximada a las areas necrosadas de las hojas de plantas enfermas y de las hojas de plantas sanas de col china, de aproximadamente 1mm de ancho y 3mm de longitud.
2. Picar finamente en condiciones de asepsia.
3. Lavar 3 veces en agua destilada estéril.
4. Trasladar a un tubo con 200μL de agua destilada estéril y se dejar reposar por 4 minutos para permitir que las bacterias fluyeran al líquido. Este procedimiento se repitió para cada una de las muestras. Con un asa bacteriologica calibrada se tomó una muestra de la suspension y se procedio a realizar una siembra masiva en agar tripticase de soya, agar extracto de col china (ver preparacion) y agar McConkey por triplicado para cada una de las muestras. Se incubaron entre 26°C y 28°C de temperatura por 48 horas. Una vez obtenido el crecimiento se realizó una
identificación microscópica por coloracion de Gram y se establecieron las características macroscópicas de las colonias aisladas.
Preparación del agar extracto de col china:
Seleccionar cinco plantulas jovenes y sanas de col china, lavar con agua corriente y posteriormente enjuagar con agua destilada esteril cuatro veces. Pesar 80 gr de las hojas, macerarlas con 200 mL de agua destilada en un mortero esteril hasta obtener una cantidad suficiente del macerado. Cubrir el mortero y dejarlo en un ambiente seco y ausente de luz durante 48 h. Luego filtrar en un erlenmeyer el contenido del extracto y agregar 2 gr de agar- agar. Esterilizar en autoclave por 15 minutos a 121 libras de presion, enfriar y servir en cajas de Petri hasta la solidificación del medio.
Fase 2. Identificación fenotípica de los microorganismos aislados
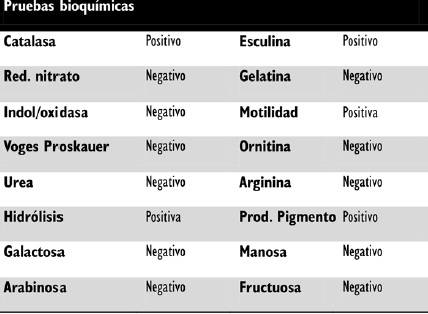
Las colonias puras obtenidas fueron sometidas a una prueba de identificacion bioquimica utilizando el sistema de pruebas automatizadas BD BBL Crystal. Identification System Enteric/Nonfermenter ID Kit. Como pruebas complementarias se realizaron: catalasa; oxidasa; nitrato; indol; urea; Voges-Proskauer; hidrolisis de gelatina; esculina; descarboxilacion de aminoacidos (ornitina, arginina y lisina); motilidad; produccion de pigmento; fermentacion de azucares OF (galactosa, arabinosa, manosa, fructuosa). Las pruebas fueron leidas despues de 48 horas de incubacion entre 26 oC y 28oC.
Fase 3. Pruebas de patogenicidad
Estudio experimental utilizando linea base multiple intersujeto de tipo A y B.
Diseño muestral: siembra total 104 plantulas. De un total de 52 muestras procedentes del municipio de Cogua, susceptibles a presentar la enfermedad (controles) y 52 muestras de col china sanas (experimentales), se estableció un control de la evolución de la enfermedad bajo dos etapas que se analizaron de forma paralela.
Caracterización de síntomas en cultivo de col china: las muestras, presentaban lesiones húmedas (S1), marchitez sobre los bordes externos con disposicion regular sobre las hojas (S2), infiriendo que las bacterias penetraron principalmente por los hidatodos como consecuencia de previas lesiones por plagas. Afeccion endofita.
Etapa A: observacion del crecimiento de las plantulas controladas en condiciones de invernadero, a temperatura y humedad, comparando criterios de presencia o ausencia de los sintomas de la enfermedad en cada una de las muestras; se realizaron observaciones cada 48 horas entre las 3 y 4 de la tarde, durante 15 dias en curso a partir del 1 de mayo del 2008. De la misma forma se llevaron a cabo las observaciones para 52 plantas del cultivo del municipio de Cogua, Cundinamarca, comparando los resultados obtenidos.
Etapa B: número de plantas inoculadas con el patogeno, bajo una concentracion minima, Escala de Mc Farland 1 y Escala de Mc Farland 4 por el método de puncion sobre las hojas, para comparar la evolucion del proceso infeccioso evaluando el comportamiento de las poblaciones por competitividad de nutrientes de acuerdo a la relacion huesped-hospedador durante las 48, 72 y 96 h.
Preparación de la biomasa: se preparó a partir de colonias aisladas de agar extracto col china con 48 horas de incubacion en caldo BHI con agitacion constante a 200 rpm durante 24 horas. Posteriormente la suspension bacteriana se preparó con una hora antes de la inoculacion en agua destilada esterilizada a escala de Mac Farland 1 (3x106mL) y 4 (12X106mL).
Disposición de las plantas: se sembraron con 15 dias de anticipacion bajo condiciones de invernadero a una humedad relativa mayor a 80% y temperatura entre 25oC y30 oC, garantizando su crecimiento optimo y disminuyendo la susceptibilidad a danos por plagas u otros microorganismos fitopatogenos.
Tabla 1. Pruebas bioquimicas para identificacion de Xanthomonas axonopodis.

Inoculación: la limpieza se realizó en condiciones de asepsia con hipoclorito de sodio al 5% a cada una de las hojas de la planta (10 hojas), posteriormente con agua destilada esterilizada para evitar cualquier grado de residualidad del sanitizante. Mediante puncion con lancetas esteriles se seleccionaron las hojas mas jovenes para realizar la respectiva inoculacion. El corte fue realizado en dos sitios de la hoja proximal a la zona vascular de la planta de un 1cm de diametro, para facilitar la diseminacion del patogeno. Con jeringa esteril, se aplico 0.2mL de la suspensión bacterial en cada herida, a 20 plantas con Escala Mc Farland 1 y a 20 con Escala Mc Farland 4. A fin de incrementar la humedad del ambiente, se utilizaron bolsas plásticas para empacar cada muestra (10 plantas), con el mismo procedimiento de inoculación se dejaron al medio ambiente sin el uso de bolsas plásticas. Se emplearon 12 muestras testigos, cada una de las cuales recibió el mismo tratamiento que las muestras anteriores, a excepción de la inoculación con la suspensión bacteriana.
Identificación fenotípica del patógeno.
Se procedió de la misma forma que en la fase dos, a partir de las muestras inoculadas que presentaron los síntomas de humedad y marchitez bacteriana respectivas a las pruebas de patogenicidad.
Fase 2: Identificación fenotípica de los microorganismos aislados.
Mediante la identificación con el sistema rápido BBL CRYSTAL: prueba oxidasa e indol, se obtuvo un resultado presuntivo con el 90% de confiabilidad de: Xanthomonas spp. Las pruebas bioquímicas fueron compatibles con Xanthomonas axonopodis, como se puede observar en la Tabla 1.
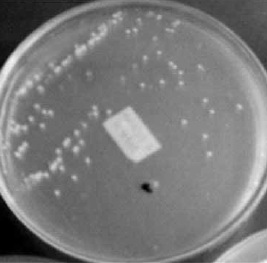
Figura 1. Aislamiento colonias bacterianas pertenecientes al género Xanthomonas.
Fuente: Agón y Castañeda, 2008.
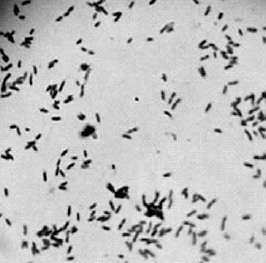
Figura 2. Bacilos Gram negativos con coloración de Gram. Fuente: Agón y Castañeda, 2008.
Tabla 2. Control de pruebas de patogenicidad.
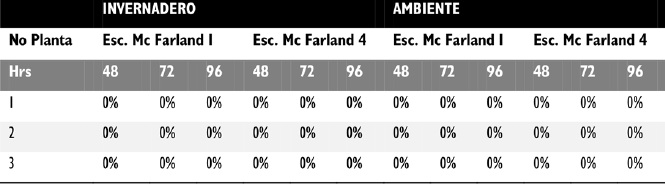
Fase 3. Pruebas de patogenicidad. En las pruebas de patogenicidad, etapa A, las plantulas sembradas y controladas durante 15 dias fueron completamente sanas en comparación con las 52 plantas bajo observación, presentes en el cultivo de Cogua, que en su gran mayoría presentaron lesiones humedas y marchitez que aumentaron progresivamente. En la etapa B, posterior a la inoculación de las hortalizas sanas con Xanthomonas axonopodis, se evidenciaron los síntomas específicos de la enfermedad a las 48 h, con un porcentaje de infección variable de acuerdo a las concentraciones Escala de Mac Farland 1 con un aumento progresivo a las 72h y 96 h. Mientras que en la escala 4 de Mac Farland, hubo menor porcentaje de infección, Figura 2. Durante la fase de confirmación del patógeno, aislado de las hortalizas infectadas en las pruebas de patogenicidad, se evidencio que la Xanthomonas axonopodis es el agente causal del proceso infeccioso en col china de los cultivos de Cogua, Cundinamarca, Tabla 2.
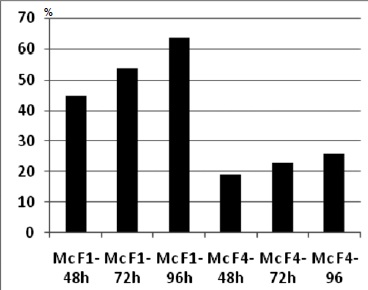
Figura 3. Porcentaje de infeccion en plantulas inoculadas con Xanthomonas axonopodis.
Los resultados obtenidos en este trabajo permiten establecer que el proceso infeccioso en los cultivos de col china ubicados en el municipio de Cogua, Cundinamarca, fueron ocasionados por una bacteria fitopatogena perteneciente a la familia Pseudomonacea, genero Xanthomonas, especie axonopodis. La infección se establecio por el ingreso de forma endófita del microorganismo a la planta por medio de los vasos conductores de la savia, provocando humedad y marchitez en los extremos de las hojas que se van diseminando lentamente generando un daño considerable en la col china.
En las pruebas de patogenicidad se observaron los síntomas específicos de la enfermedad con un crecimiento constante en relación al tiempo en el que fueron realizadas las observaciones. Sin embargo, la concentración del inoculo influye directamente en el porcentaje de infección (22,23), teniendo presente que las plantas inoculadas con escala 1 Mc Farland es mayor en comparación con aquellas manejadas a escala 4 Mc Farland. El término de densidad de poblaciones es un parámetro determinante para explicar este fenómeno.
Es evidente que la relación microorganismo–nutriente determina la supervivencia de Xanthomonas axonopodis en el huésped. Como complemento a este trabajo sera importante realizar una curva de crecimiento de la bacteria aislada para establecer las diferente fases de crecimiento partiendo de la densidad microbiana de la escala de Mc Farland 1 que fue con la que se obtuvo el mejor resultado de infección. Sin embargo, no pueden desconocerse otros factores relacionados por diversos autores como predisponentes para sufrir la enfermedad, uno de ellos es la susceptibilidad de la planta, otro el potencial patógeno de la bacteria y las condiciones ambientales para su desarrollo (10,24).
Sobre la susceptibilidad de las cruciferas a la infección por Xanthomonas, es importante mencionar que en las pruebas preliminares para definir el medio de cultivo para el crecimiento del microorganismo, inicialmente se realizó el medio con plantas de edad madura y no se obtuvo crecimiento. Posteriormente se utilizaron plántulas jóvenes que fueron las que finalmente se utilizaron en el experimento y con las que se logró un buen crecimiento del patógeno. Esta prueba y los conceptos de la fisiología de plantas reportadas (25,26), permiten inferir que los compuestos fenólicos presentes en col china y otras hortalizas de la familia de las Cruciferas, influyen en la regulación del crecimiento de la bacteria y por lo tanto son los primeros estados vegetativos de la planta los más susceptibles de infección. Esto evidencia el momento en que es más importante reforzar las condiciones de nutrición de la planta y los controles para evitar el ataque del patógeno.
Sobre el potencial de infección de Xanthomonas axonopodis se ha estudiado a fondo el sistema de secreción de efectores tipo III (27,28), desarrollado por las bacterias Gram negativas como estrategia de infeccion. Este sistema inyecta más de 20 proteínas efectoras en la planta con la cual se establece una relación gen de virulencia – gen de resistencia en donde se ponen en juego las capacidades bioquímicas de la interacción huésped y patógeno (29-32). Este conocimiento permitirá a futuro planear estrategias moleculares para disminuir las pérdidas económicas por este patógeno.
Sobre el factor ambiental y como resultado en esta investigación, se puede afirmar que la humedad y la temperatura aplicados en el experimento si fueron determinantes en el proceso de infección. Estos valores fueron tomados de observaciones realizadas por investigadores de la Universidad de Ciencias Ambientales y Aplicadas UDCA en ensayos preliminares en invernadero. El grupo ha considerado a futuro hacer un estudio de la cinética del microorganismo para conocer su comportamiento de crecimiento, determinar sus genes de virulencia e investigar la microbiota con potencial antagonista como alternativa de control biologico que complemente un manejo integrado de plagas que disminuya las pérdidas de producción de los agricultores de Cogua, municipio de Cundinamarca, Colombia.