
Evaluación del efecto biocontrolador de Bacillus spp., frente a Fusarium spp., bajo condiciones de invernadero en Rosmarinus officinalis L
Lucia Constanza Corrales, MSc1, Ligia Consuelo Sánchez MSc1, Jairo Cuervo PhD2, Diana Bautista3, Lady González3, Marcela Guevara3
1Docentes investigadoras. Universidad Colegio Mayor de Cundinamarca. Bogotá, Colombia.
2Docente investigador. Universidad Nacional de Colombia.
3Estudiantes. Programa de Bacteriología y Laboratorio Clínico, Facultad de Ciencias de la Salud. Universidad Colegio Mayor de Cundinamarca. Bogotá, Colombia.
Correspondencia: lcorralesr07@gmail.com
Recibido: 03-18-2011 / Aceptado: 05-04-2011
El ensayo se realizó con 30 plántulas de romero, un control negativo y uno positivo, bioensayos con sólo Bacillus spp., y tratamientos con Bacillus spp., más el patógeno. Para evaluar la severidad del patógeno y el comportamiento de las bacterias cada ensayo se realizó por triplicado y bajo condiciones de invernadero. En las pruebas de antagonismo in vitro B1 y B2 presentaron entre el 70–100% de inhibición del micelio y B14 y E2 entre el 40–69%. Los Bacillus spp., disminuyeron la severidad de la marchitez vascular en todos los ensayos; por la producción de sustancias antifúngicas facilitaron el aumento del peso seco de las hojas de las plantas al permitir la obtención de nutrientes y B14 aumentó la longitud de la raíz y el tallo. Se precisa secuenciar el aislamiento de Fusarium, para confirmar la especie.
Palabras clave: fitopatógeno, marchitez vascular, Rosmarinus officinalis L.
Evaluation of biocontrol effect of Bacillus spp. vs. Fusarium spp. under greenhouse conditions in Rosmarinus officinalis L.
This study evaluates the effect of the genus Bacillus sp as biological control of fungal phytopathogens in plants, mostly through antagonistic relations that induce cell death in natural way. Fusarium oxysporum is well-known pathogen related with vascular wilt and root rot in a variety of plants; colonizing the vessels and blocking them to cause yellowing of leaves due to the impossibility in the transport of nutrients, causal of serius economic loss in national agriculture. Several mechanisms have been established to control this filamentous fungi within which are the extensive and variable use of agrochemicals and pesticides, but due its harmful effects to the environment, has begun to replace by the use of the genus Bacillus.
Its biocontrol effect is mediated by the biochemical profile, as they produce multiple biologically active metabolites; Bacillus subtilis produces fengycin and iturin A, and Bacillus brevis and gramicidin S (1-5), able of inhibit the normal growth and development of other organisms, this suggest its use as a biocontrol of pests to strengthen the current environmental quality standards.
Keywords: Bacillus sp, Fusarium oxysporum, biocontrol, genes, metabolites.
Es importante resaltar que Colombia exporta hierbas aromáticas principalmente a Norteamérica y Europa (2). La producción del romero como hierba aromática condimentaria y especialmente como esencia, se perfila como una actividad promisoria (3). Las exportaciones de éstas especias se perjudican, cuando las aromáticas no se encuentran en un estado fitosanitario óptimo y por ende las ganancias de los cultivadores y empresarios disminuye.
El manejo convencional de los problemas fitosanitarios por parte de los agricultores se basa en la aplicación de químicos, generando deterioro en los suelos y disminución en la calidad del producto agrícola. Razón por la cual en los últimos años las investigaciones están encaminadas a plantear sistemas de control de fitopatógenos, usando biocontroladores como alternativa para mantener el equilibrio en los ecosistemas agrícolas. La utilización de microorganismos saprófitos, especialmente seleccionados, pertenecientes a la flora de los suelos agrícolas para controlar fitopatógenos, representa una importante herramienta y una alternativa de control biológico (4).
Entre los microorganismos más utilizados para el control de fitopatógenos fúngicos se encuentra el género Bacillus spp. (5,6), debido a que tienen la facilidad de digerir la quitina, además de la producción de antibióticos como: bacitracina, polimixina, tirocidina, gramicidina y circulina, entre otros (7). Este estudio plantea una posible alternativa para el control de la enfermedad, al establecer el efecto biocontrolador de Bacillus spp., frente a Fusarium spp., bajo condiciones de invernadero en plantas de romero durante su etapa vegetativa, experimento que se realizó en los invernaderos de la Universidad Nacional de Colombia, Sede Bogotá.
Recuperación de microorganismos aislados de rizósfera de plantas aromáticas. El procedimiento para la descongelación de los microorganismos en éste estudio fue realizado de acuerdo al protocolo descrito por Corrales y Sánchez en el 2005, con modificaciones (8). Los viales de las cepas utilizadas correspondían a L2, L3, L4, L7, L10 aisladas con anterioridad de la planta estrellita de Belén (9); H4, AHE, A. iwoffi, MISC, 9.5.1, 7.4.1, 7.4, 4.5, 3.5, 2.5, 2.4, 4.4, 1.5 aisladas de mejorana (10); E4, E2, E1 aisladas de estragón(11); B1, B2, B3, B4 aisladas de tomillo (12); y B14 aislada de albahaca (13), para un total de 26 microorganismos.
Identificación de los microorganismos seleccionados. Se seleccionaron siete cepas de acuerdo a las características de viabilidad y de crecimiento que presentaron. Se realizó la identificación a las cepas seleccionadas (9.5.1, B1, B2, B3, B4, E2, B14), a través de pruebas bioquímicas manuales (TSI, citrato de Simmons, urea, motilidad, nitritos, NaCl 4.5%, glucosa, xilosa, arabinosa, almidón) y automatizadas por el sistema BBL CRYSTAL.
Aislamiento e identificación del patógeno. Se utilizó un aislamiento de Fusarium spp., obtenido anteriormente de plantas de romero (Rosmarinus officinalis) que presentaban signos y síntomas de marchitez vascular de cultivos de la Universidad Nacional, sede Bogotá. A éste se le realizó coloración con azul de lactofenol, para la identificación microscópica por claves taxonómicas específicas del género Fusarium (Fuskey).
Pruebas de patogenicidad. Con el fin de determinar sí el aislamiento proporcionado por la
Universidad Nacional de Colombia era el causante de marchitez vascular en romero (Rosmarinus officinalis); se realizaron pruebas de patogenicidad en las plántulas de un mes, con cuatro repeticiones; la evaluación se efectuó a los ocho días con la medición de severidad. Las plántulas fueron lavadas con agua de chorro y sometidas a desinfección con hipoclorito de sodio al 10% por 5 minutos, posteriormente fueron lavadas con abundante agua destilada estéril y sumergidas en alcohol al 70%, luego se dejaron secar en toallas absorbentes (14). En un ambiente antiséptico se hizo una herida en la base del tallo, sobre la misma se colocó el inóculo (el hongo con 15 días de desarrollo en medio PDA), cubriendo la zona tratada con gasa humedecida en agua destilada estéril. Las plantas control fueron sometidas al mismo tratamiento colocándoles solamente gasa humedecida (15).
Cada uno de los tratamientos fue sembrado en turba estéril a capacidad de campo. Las plantas se mantuvieron en cámara húmeda constituida por bolsas de plástico transparentes. Tanto las plantas inoculadas como los controles fueron mantenidos a 23°C ±3°C bajo condiciones de invernadero (15). Estas fueron evaluadas macroscópicamente y al estereoscopio a los ocho días para observación de los haces vasculares a través de un corte longitudinal en el tallo. Para la determinación de los postulados de Koch los tallos se sembraron en agar Rosa de Bengala y PDA con el fin de obtener el patógeno; la confirmación de las estructuras microscópicas se realizó con coloración de azul de lactofenol.
Prueba de enfrentamiento directo. Para observar el potencial antagónico in vitro de las bacterias B1, B2, B3, B4, E2, 9.5.1 y B14 contra Fusarium spp., se utilizó la metodología empleada por Acosta y Avellaneda (12), con algunas modificaciones. Se sembró el fitopatógeno en el centro de una caja de Petri y cuatro biocontroladores por estría a una distancia de 3cm respecto al patógeno. Los ensayos se sembraron por triplicado en agar PDA por 7 días a 28°C, y al mismo tiempo se hizo un control del crecimiento del aislamiento del Fusarium spp., utilizado (12).
La tasa de crecimiento micelial se dio en centímetros por día, se determinó teniendo en cuenta el radio de crecimiento de la colonia fúngica calculando su magnitud mediante la expresión sugerida por Mead (9):
T.C= (Cf -Ci)/ (Tf-Ti)
El porcentaje de inhibición del crecimiento micelial se calculó empleando la fórmula de Samaniego y colaboradores, citado por Acosta y Avellaneda (12).
% inhibición= ((R1-R2) / R1)* 100
El comportamiento de inhibición mostrado por los diferentes aislamientos se agrupó de la siguiente manera (9):
- Negativo: ausencia de zona de inhibición o un porcentaje menor de 10% y crecimiento normal de la colonia fúngica, de forma similar al control.
- Baja: ausencia de zona de inhibición o con un porcentaje entre 10–39% y con disminución en el crecimiento de la colonia fúngica.
- Media: ausencia de zona de inhibición o un porcentaje entre 40–69% y con disminución en el crecimiento de la colonia fúngica.
- Positivo: presencia de zona de inhibición definida o en un porcentaje entre 70–100%.
Material vegetal. Se sembraron 200 plántulas de romero (Rosmarinus officinalis) por esqueje en una bandeja en el invernadero de propagación de la Universidad Nacional de Colombia. Después de un mes, se seleccionaron 30 plántulas homogéneas en tamaño, sin signos y síntomas de enfermedad.
Preparación del inóculo del patógeno. Para la preparación del inóculo de Fusarium spp., se utilizó un hongo de 15 días de crecimiento en medio PDA. A éste se le agregó 20 mL de agua destilada estéril y se raspó con un asa para despegar los conidios. Posteriormente, se filtró la suspensión con dos gasas estériles (16) y se agitó en vortex durante un minuto.
Luego se agregó esta suspensión a frascos estériles de 75 mL con agua destilada estéril. Después se realizó un recuento de conidios en cámara de Neubauer, para obtener una concentración de 1x106 conidios/mL y con ayuda de un bisturí a las plantas se les cortó 10 mm de la base del tallo, inoculando en esta 1mL de la suspensión de Fusarium spp., con jeringa. En los controles negativos se reemplazó el inóculo de Fusarium spp., por agua destilada estéril (12).
Preparación del inóculo de los biocontroladores. Para la preparación del inóculo de los biocontroladores se realizó siembra de las bacterias en agar Mueller– Hinton, a las 24 horas de crecimiento de estas se preparó en caldo BHI la concentración estandarizada a 108 UFC/mL, usando la escala de Mac Farland (17).
Montaje del bioensayo. Cuando las plántulas alcanzaron una altura promedio de 10 cm se procedió a medir la longitud del tallo, raíz y longitud total por planta. Se lavaron con agua destilada estéril para eliminar el exceso de suelo y se hizo un corte en la base del tallo bajo condiciones asépticas (14). Luego se sumergieron en frascos que contenían las suspensiones bacterianas B14, E2, B1, B2 durante 15 min (18). A las 24 horas fue inoculado por inyección 1 mL de la suspensión del patógeno en la herida realizada en la base del tallo. Las plántulas fueron colocadas bajo condiciones de invernadero durante 35 días bajo una polisombra. En el ensayo se montó un testigo positivo y uno negativo, cuatro bioensayos que contenían sólo los Bacillus spp., biocontroladores y cuatro tratamientos que contenían cada uno los Bacillus spp., con el patógeno, todos estos por triplicado.
Evaluación de la severidad. Las plantas fueron evaluadas cinco veces durante 35 días. La evaluación de la severidad se llevó a cabo mediante la elaboración de una escala establecida por primera vez para esta especie vegetal, Figura 1, y se utilizó la fórmula de Castaño (19,20):
Severidad(%): sumatoria (n*1)/N
Severidad %: severidad de la enfermedad expresada en porcentaje del tejido afectado.
n: número de unidades de muestreo clasificadas en cada clase.
I: índice de severidad por cada clase.
N: número total de unidades de muestreo observadas.
Confirmación del patógeno en haces vasculares. Se realizaron cortes longitudinales a los tallos, con el fin de observar a través del estereoscopio los haces vasculares de todas las plantas del ensayo, identificando síntomas internos de marchitez vascular; posteriormente se sembró en agar PDA dos segmentos de estos tallos, previa limpieza y desinfección, con el fin de confirmar la presencia o ausencia del hongo fitopatógeno.
Evaluación del crecimiento y peso seco. Al finalizar el ensayo se procedió a medir la longitud del tallo y raíz para determinar diferencias entre estas. Las plantas fueron llevadas a un horno a 70°C por tres días para determinar su peso seco.

Figura 1. Escala de severidad en romero establecida por Bautista, González y Guevara
Identificación de microorganismos seleccionados
Los resultados de las pruebas bioquímicas manuales se ven en la Tabla 1 y los de las pruebas automatizadas (BBL CRYSTAL) en la Tabla 2.
Identificación del patógeno. Las características microscópicas y macroscópicas del fitopatógeno concuerdan con Fusarium acuminatum, Tabla 3.
A) Colonia de Fusarium aislado de romero.
B) Esporodoquios de color amarillo, Figura 2.
A) macroconidias de 25μm con 4-6 septos, sin coloración, observación microscópica 40x.
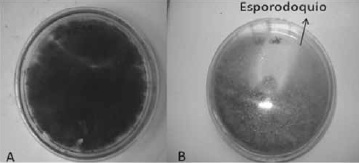
Figura 2. Características macroscópicas de Fusarium sp., en agar PDA
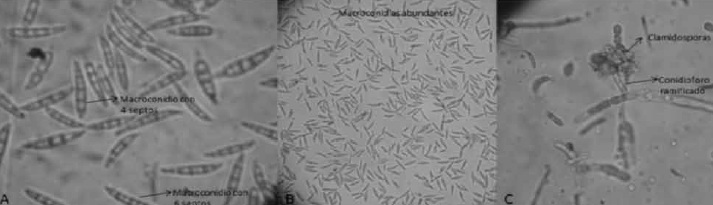
Figura 3. Observación microscópica de las estructuras del aislamiento del Fusarium spp.
Tabla 1. Actividad enzimática por pruebas bioquímicas manuales.
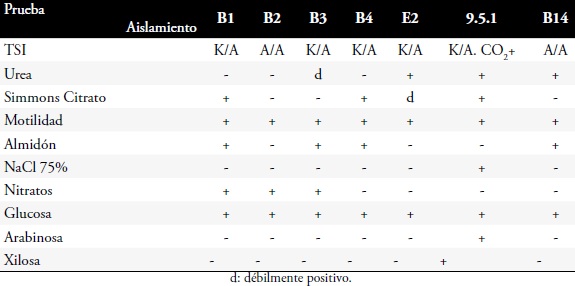
Tabla 2. Identificación de microorganismos por actividad enzimática en método automatizado.
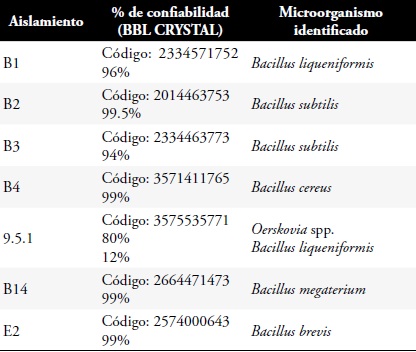
Tabla 3. Características macroscópicas y microscópicas de un aislamiento de Fusarium spp., en romero.

B) macroconidias abundantes en cámara de Neubauer, observación microscópica 10x. C) clamidosporas globosas y conidioforo ramificado con azul de lactofenol, observación microscópica 40x. Bautista, González y Guevara (2009).
Pruebas de patogenicidad. Los cuatro tratamientos presentaron signos y síntomas de marchitez vascular macroscópica y al estereoscopio. El control negativo no presentó signos ni síntomas. En agar rosa de Bengala y PDA, se evidenció el crecimiento de un hongo con micelio rojo claro el cual concuerda con el Fusarium inoculado como se observa en la Figura 4A, en la coloración de azul de lactofenol muestra características compatibles con el fitopatógeno estudiado como se observa en la Figura 4B.
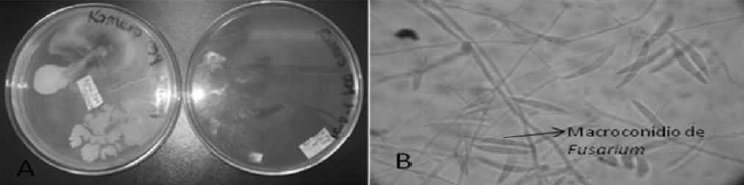
Figura 4. Crecimiento del hongo en agar PDA y Rosa de Bengala y observación microscópica. A) Aislamiento del fitopatógeno en agar PDA, y rosa de bengala. B) Observación microscópica en 40x con coloración de azul de lactofenol del hongo crecido en agar PDA. Bautista, González y Guevara (2009).
Tabla 4. Resultados del porcentaje de inhibición y tasa de crecimiento micelial del aislamiento de Fusarium spp., frente a los Bacillus spp.
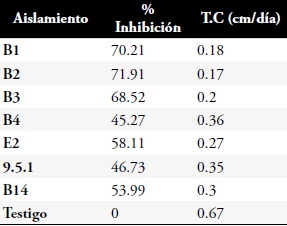
Prueba de enfrentamiento directo. Los Bacillus analizados resultaron ser eficientes contra el ataque del Fusarium spp., aislado en las pruebas in vitro. Los resultados del porcentaje de inhibición y la tasa de crecimiento micelial frente al patógeno se hicieron en base al promedio de las tres repeticiones por bacteria, estos datos se referencian en la Tabla 4 y Figuras 5 y 6. B1 y B2 fueron positivas presentando un porcentaje entre el 70–100% de inhibición del micelio. B3, B4, B14, E2 y 9.5.1 mostraron una inhibición media con un porcentaje entre 40–69%. Ninguno de los Bacillus obtenidos tuvo un porcentaje bajo de inhibición ni negativo.
Montaje del bioensayo. Con base en los resultados obtenidos en las pruebas bioquímicas, las pruebas de antagonismo y la pureza de la cepa no se pudo trabajar con las siguientes bacterias: B3 pues correspondía a Bacillus subtilis al igual que B2, pero con menor porcentaje de inhibición; B4 presentó contaminación al momento de montar el bioensayo y 9.5.1 en la identificación bioquímica arrojó valores de confiabilidad menores a un 90%: compatibilidad con Oerskovia spp., en un 80% y con Bacillus liqueniformis en un 12%, por lo tanto no se utilizó. Las bacterias utilizadas para el montaje de la prueba de campo fueron: B1 (Bacillus liqueniformis), B2 (Bacillus subtilis), B14 (Bacillus megaterium) y E2 (Bacillus brevis).
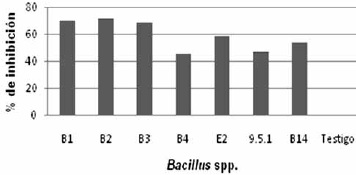
Figura 5. Porcentaje de inhibición de Bacillus spp., frente al aislamiento de Fusarium spp.
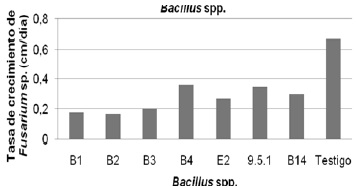
Figura 6. Tasa de crecimiento micelial del aislamiento de Fusarium spp., frente a Bacillus spp.
Evaluación de la severidad. Los resultados de la severidad se muestran en la Figura 7. Todas las bacterias fueron eficientes frente a Fusarium spp bajo condiciones de invernadero comparado con el control positivo. La menos eficiente fue B14 con un porcentaje de severidad de 31,6%. E2 y B2 mostraron resultados iguales con 13,3% y B1 se acerca a estos resultados con 15%.
Confirmación del patógeno en haces vasculares. A través del estereoscopio se pudo observar un color gris claro en los haces vasculares a excepción del testigo positivo donde dos de las tres plantas (A, B y C) mostraron un color marrón. En el momento del corte varias plantas mostraron un endurecimiento en el sitio de inoculación. Los datos del crecimiento del patógeno en medio PDA se observa en la Tabla 5.
Tabla 5. Crecimiento del patógeno en medio PDA.

Evaluación del crecimiento y peso seco. En la Figura 8 se observa el porcentaje de crecimiento de la raíz de los bioensayos y testigos. En ésta se evidencia mayor crecimiento en todos los bioensayos respecto a los testigos, sin embargo B14 (Bacillus megaterium) favoreció el mayor crecimiento radicular con un 28.1% y con una diferencia de 23.6% respecto al control negativo. El control positivo presentó un crecimiento demasiado bajo con una diferencia de 3.7% respecto al negativo.
La Figura 9 muestra los resultados obtenidos en el porcentaje de crecimiento del tallo en bioensayos y testigos. El bioensayo con B14 (Bacillus megaterium) presentó el mejor crecimiento con un 18.1% en comparación con los demás. Si se compara con el control negativo se observa que el crecimiento fue mayor en 1.4%, mostrando una diferencia significativa; los demás bioensayos no mostraron incremento en la longitud del tallo con respecto al control negativo, pero si con respecto al positivo.
La Figura 9 también muestra que la presencia del patógeno en el testigo positivo produjo disminución del crecimiento del tallo en un 8% con respecto al control negativo.
La Figura 10 muestra que se obtuvo mayor peso seco en hojas en todos los tratamientos, en comparación con los bioensayos y los testigo. Sin embargo, fue con B2 el que mostró el mayor porcentaje frente a los testigos. En el montaje de los tratamientos, B14 reveló el valor más alto seguido de B2 con diferencias significativas con respecto a los testigos. Al comparar los resultados obtenidos entre tratamientos, bioensayos y testigos, B2 mostró los resultados más altos. En cuanto al peso seco en raíz, se evidencia que entre bioensayos y tratamientos no hay una diferencia significativa. Sin embargo, E2 obtuvo los mayores resultados con respecto al testigo negativo. En lo relacionado con el peso seco en tallo tampoco se encontraron diferencias significativas entre los resultados de los bioensayos y los tratamientos.
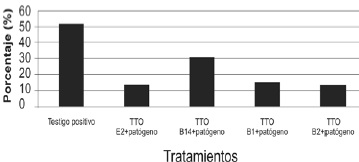
Figura 7. Porcentaje de severidad de marchitez vascular en plantas de romero.
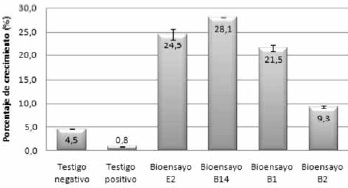
Figura 8. Crecimiento inicial y final de raíz en plantas de romero.
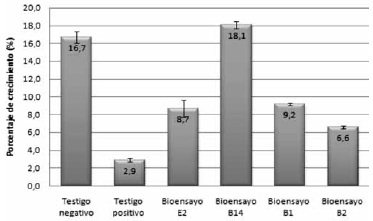
Figura 9. Crecimiento inicial y final de tallo en plantas de romero.
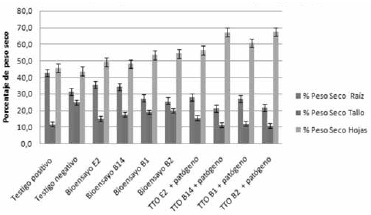
Figura 10. Evaluación de peso seco en raiz, tallo y hojas de plantas de romero.
En cuanto a la descripción microscópica, se reportan para la especie aspectos como la ausencia o escasez de microconidias, lo cual no representa un indicador taxonómico fiable; sin embargo, aspectos como la curvatura moderada de las macroconidias y el número de septos que va desde cuatro a seis por estructura para Fusarium acuminatum, concuerda con lo encontrado en el aislamiento como lo muestra la Figura 3., así como la formación de clamidosporas lenta en grupos o cadenas (21).
F. acuminatum fue descrito por primera vez por Ellis y Everhart a partir de tallos de papa en Ginebra, Nueva York (22). Este hongo se encuentra en las regiones templadas por lo general como un saprofito del suelo o asociado a las raíces y las coronas de las plantas. En ocasiones puede estar asociado con enfermedades de raíz y corona de una variedad de plantas, sobre todo en legumbres y granos de cereales cultivados en Canadá, Europa y la antigua Unión Soviética (21).
En Colombia no se ha reportado esta especie de Fusarium, como saprófito o patógeno. El Ministerio de Comercio, Industria y Turismo reporta en las estadísticas de importaciones a Colombia, que productos como trigo, cebada, maíz, soya, arroz y legumbres provienen de Canadá, Rusia y algunos países de la Unión Europea (23,24), donde se ha identificado esta especie de Fusarium. Lo anterior plantea la posibilidad de que el patógeno haya ingresado al país en estos productos de importación.
Por ende se hace esencial realizar la secuenciación de éste aislamiento, con el fin de confirmar la especie y en tal caso hacer el reporte en Colombia. Se confirmó el Fusarium aislado como agente patógeno a través de los postulados de Koch al demostrarse lo siguiente: el patógeno siempre estuvo asociado con la enfermedad; se aisló en agar PDA, a partir de este se estudiaron sus características específicas; luego se inoculó en plantas sanas las cuales presentaron síntomas característicos de la enfermedad y por último fue reaislado de las plantas inoculadas nuevamente en agar PDA, presentando las mismas características macroscópicas y microscópicas (25).
Todas las bacterias presentaron un buen desempeño en las pruebas antagónicas in vitro, resultado esperado ya que las especies del género Bacillus han sido reportadas como efectivos biocontroladores de múltiples fitopatógenos por su capacidad de producir varios antibióticos de amplio espectro, característica que ha permitido utilizarlos como fungicidas comerciales (26-29).
B1 (Bacillus liqueniformis) y B2 (Bacillus subtilis), presentaron un desempeño positivo en las pruebas in vitro contra Fusarium probablemente por la capacidad de secretar lipopéptidos antibióticos del grupo Iturin cuyo mecanismo de acción va dirigida sobre la permeabilidad de la membrana y la composición lipídica de la célula fúngica, de tal forma que inhibe el crecimiento micelial y la esporulación del hongo (30- 32). B3, B4, B14, 9.5.1 y E2 presentaron un nivel de inhibición medio. B3 (Bacillus subtilis) corresponde a la misma especie que B2 presentando porcentajes de inhibición similares y las mismas características antagónicas; B4 (Bacillus cereus) produce zwittermicin A, con características estructurales similares al quitosano, el cual actúa como antibiótico frente a fitopatógenos (33-35). B14 (Bacillus megaterium) produce amilasas, proteasas, y antibióticos como el megacin, además de otras sustancias antagónicas (36,37). E2 (Bacillus brevis) produce péptidos extracelulares antagónicos que inducen a la hinchazón del citoplasma de las células que conforman las hifas, también inhibe la germinación de conidios, así como la formación del micelio vegetativo del hongo (38) por último 9.5.1 (Oerskovia sp.) no ha sido reportado como biocontrolador, sin embargo, mostró una capacidad antagónica media en las pruebas in vitro.
Las plantas de romero que contenían los tratamientos de Bacillus spp., con Fusarium spp., no presentaron un grado de severidad alto de marchitez vascular bajo condiciones de invernadero posiblemente porque:
1. Los Bacillus spp., fueron efectivos frente al ataque del hongo mediante la producción de diferentes antibióticos y enzimas que evitaron el crecimiento del hongo.
2. El aislamiento de Fusarium spp., utilizado perdió virulencia y patogenicidad debido a la inhibición enzimática producida por las sucesivas resiembras en medios de cultivo artificiales, que generó cambios metabólicos en éste y por ende un grado de severidad bajo en las plantas inoculadas (39). Autores como Bustamante, ven la necesidad de revirulentar los hongos con fragmentos de tejido asociados a la planta; esto con el fin de mantener activos los genes implicados en la patogénesis y virulencia. La severidad de los síntomas de marchitez vascular varía con el grado de patogenicidad y virulencia de la especie de Fusarium, así como de las condiciones del experimento (40).
3. La agresividad de Fusarium spp., observada bajo condiciones de invernadero no fue la misma a la evidenciada en las pruebas de patogenicidad debido al cambio de las condiciones agroambientales (suelo, temperatura, humedad, luz). La temperatura del suelo pudo no haber sido la adecuada y por ende se vio un retraso en la expresión de síntomas externos, pues según lo reportado a temperaturas menores de 20°C la expresión de síntomas de marchitez vascular en las plantas se retrasa considerablemente (16).
4. La técnica de inoculación empleada en este trabajo es considerada confiable para garantizar la presencia del patógeno (16), sin embargo, demostró ser poco eficiente, probablemente porque se realizó inyección del inóculo del patógeno en la base del tallo y no se sumergió la raíz como lo sugieren otros protocolos. Con esta técnica se pudo haber interrumpido el proceso de infección en alguno de los siguientes puntos: a) el reconocimiento de señales de la raíces de la planta, b) la adhesión a la superficie de la raíz y la diferenciación de hifas de penetración, c) la invasión del cortex de la raíz y la degradación de barreras físicas tales como la de endodermos hasta llegar al tejido vascular, viéndose así afectada la activación de la cascada de señalización MAPK (proteína quinasa activada por mitógenos) esencial en la patogénesis de Fusarium (41).
5. Es posible que la planta de romero haya generado la síntesis de metabolitos secundarios como las fitoalexinas que actúan como mecanismo de resistencia en las plantas, debido a la acción de factores como elicitores o inductores exógenos, producidos por Fusarium, a consecuencia del daño mecánico generada por la inoculación; y endógenos, producidos por las plantas en respuesta a la situación de estrés provocada en el momento de la inoculación (42,43). De tal forma que una alta concentración y acumulación de fitoalexinas pudo inhibir el desarrollo del patógeno (25).
Las plantas inoculadas en el tratamiento con B14 (Bacillus megaterium), mostraron aumento de crecimiento en raíz, probablemente porque los Bacillus spp., y un amplio número de rizobacterias, producen compuestos promotores de crecimiento en plantas como el ácido indol-3-acético (AIA), auxinas, giberelinas y citoquininas que permiten la captación de minerales disponibles como nitrógeno y fósforo en el suelo. La presencia de estos compuestos en la rizósfera parece estimular directamente el crecimiento de la planta (44-46). Bacillus megaterium, ha sido reportado en otros estudios como promotor de crecimiento y modificador de la estructura de la raíz y específicamente en Arabidopsis (47) y de giberelinas, fitohormonas esenciales que controlan muchos aspectos del desarrollo de la planta que promueven la elongación del tallo, al estimular la división celular (48,49).
Los Bacillus aumentan el peso seco del follaje cuando se utilizan para biocontrol o como bacterias promotoras de crecimiento (PGPR) (50), lo que explicaría los resultados observados en la Figura 9. Los valores de peso seco obtenidos en el control negativo, en los bioensayos y en los tratamientos sugieren que las plantas absorbieron los nutrientes, ascendieron por los haces vasculares y se acumularon principalmente en hojas, probablemente porque la enfermedad aún no se había establecido, si se compara con el control positivo. Los resultados del bioensayo positivo sugieren que los nutrientes no pudieron ascender por los haces vasculares debido al taponamiento ocasionado por la acción patógena del Fusarium, razón por la cual se obtiene un mayor peso en la raíz.
En la comprobación de la presencia del patógeno, éste se recuperó a partir de: el control positivo, confirmando una vez más los postulados de Koch con el cual se comprueba que el Fusarium acuminatum aislado desde un principio es el causante de la marchitez vascular en romero, pues no solamente se demostró su presencia a través del estereoscopio, sino también por medio de la recuperación en medio PDA a partir del tejido vegetal.
En los tratamientos de B1+ Fusarium y B2 + Fusarium, no se observaron síntomas que evidenciaran la presencia del patógeno a través del estereoscopio ni tampoco se pudo obtener a partir del cultivo de tejido de romero en medio PDA. En una de las repeticiones del tratamiento de B1 + Fusarium se observó el crecimiento de un micelio blanco, el cual se pensó fuera el patógeno pero al realizar montaje con azul de lactofenol se observó la presencia de micelio estéril, lo cual no permitió identificar el microorganismo.
Es posible que las causas estén asociadas con la desintegración de las paredes miceliales que da como resultado la destrucción total de las estructuras celulares de los hongos patógenos, demostrando con ello la particular habilidad de Bacillus spp., para inhibir el crecimiento del patógeno (30,33,37,51) o que el tejido sembrado no estaba afectado por Fusarium.
Los resultados de esta investigación permiten concluir que: Fusarium acuminatum es el agente causal de la marchitez vascular en plántulas de romero (Rosmarinus officinalis) de la Universidad Nacional de Colombia sede Bogotá. Los cuatro aislamientos de Bacillus spp., presentaron actividad antagónica in vitro frente a Fusarium spp., con un porcentaje de inhibición mayor al 45%, ya que las cuatro especies utilizadas secretan sustancias anti-fúngicas propias del género. Los cuatro aislamientos de Bacillus spp., presentaron efecto biocontrolador bajo condiciones de invernadero sobre Fusarium spp., en romero al disminuir la severidad de la marchitez vascular en las plántulas por debajo del 50%, lo que valida los resultados obtenidos en las pruebas in vitro y lo señalado en la literatura acerca de estas bacterias. B14 (Bacillus megaterium) promovió el crecimiento de raíz y tallo en plántulas de romero en comparación con los otros Bacillus bajo condiciones de invernadero.
Se evidenció concordancia entre los resultados obtenidos en la inhibición en las pruebas in vitro y los de severidad bajo condiciones de invernadero en plántulas de romero con Bacillus spp., frente a Fusarium acuminatum. El empleo de Bacillus spp.,como microorganismo de biocontrol contra Fusarium acuminatum, demuestra ser una alternativa eficiente para el manejo de éste hongo en plántulas de romero bajo condiciones de invernadero.
Para futuros trabajos se recomienda evaluar en fase de campo los cuatro Bacillus spp., utilizados en este estudio con el fin de corroborar su efecto biocontrolador contra Fusarium spp. Realizar la identificación por medio de técnicas moleculares del aislamiento de Fusarium spp., utilizado con el fin de corroborar la especie de este patógeno, y divulgar el primer reporte de éste en plantas de romero en Colombia. Observar el efecto antagónico de estos Bacillus spp. a diferentes concentraciones contra Fusarium spp., con el fin de estandarizar la técnica a la cual resultan ser más eficiente su inoculación, y finalmente ccaracterizar por PCR los genes que codifican la producción de antibióticos y/o enzimas implicados en la capacidad biocontroladora de los Bacillus spp., utilizados en éste estudio.