Pseudomonas oryzihabitans: un microorganismo de creciente interés científico
Diana Carolina Gutiérrez Bustos1, Ana María Hernández Marín1, Lucía Constanza Corrales Ramírez2
1Bacteriólogas y Laboratoristas Clínicas de la Universidad Colegio Mayor de Cundinamarca.
2MSc. Docente Investigador Universidad Colegio Mayor de Cundinamarca.
Correspondencia: lcorralesr07@gmail.com
Recibido: 20-02-09 / Aceptado: 27-03-09
La identificación de esta especie de Pseudomonas por técnicas de biología molecular resulta más complicado que para otras, ya que de esta se encuentran reportados muy pocos genes en la base de datos del Centro Nacional para la Información Biotecnológica NCBI. La secuencia que se ha utilizado con mayor frecuencia para identificar esta bacteria en sus diferentes habitats es la de la subunidad ADNr 16S, codificada por el gen rrs o 16S ADNr, considerado un buen marcador molecular; debido a que su estructura y función han permanecido constantes durante un tiempo muy prolongado. La técnica de la PCR, resulta ser adecuada para confirmar la identificación de esta cepa dada su especificidad, precisión y bajo costo.
Palabras Clave: biocontrolador, microorganismo, Pseudomonas oryzihabitans, rizosfera, simbiosis.
Pseudomonas oryzihabitans: A Microorganism of Growing Scientific Interest
This article aims to determine the microbiological, biochemical and molecular characteristics of the Pseudomonas oryzihabitans bacteria, emphasizing its importance on public health. the conditions for sustainability in vitro areestablished to project its use in biotechnology areas such as agri-environment, particularly as biocontrol of larvaland plant growth promoter, and in industry as an alternative in the production of vitamin C.
The identification of this species of Pseudomonas by molecular biology techniques is more difficult than others, as they are reported very few genes in the NCBI database. The sequence that has been used most often to identify the bacteria in different habitats is that of the 16S rDNA subunit, encoded by the gene rrs or 16S rDNA, which is considered a good molecular marker, because its structure and function have remained constant over a very long time. The PCR technique proves to be adequate to confirm the identification of this strain because of its specificity, precision and low cost.
Keywords: Biocontrol, microorganism, Pseudomonas oryzihabitans, rhizosphere, symbiosis.
¿Pseudomonas oryzihabitans ó Flavimonas oryzihabitans?
El género Pseudomonas, descrito en 1894 por Migula, comprende una gran variedad de especies clasificadas por medio de la identificación bioquímica tradicional y por técnicas de hibridización (7-10). Actualmente es un género que es dinámico en el número de especies, dado que se han reclasificado varias de ellas provenientes de otros géneros teniendo en cuenta el ADNr 16S (11,12). Sin embargo, aún existen discrepancias a la hora de nombrarlos. Pseudomonas oryzihabitans, que inicialmente fue denominada como Chromobacterium typhiflavum (13), ha sido clasificada por el Centro para el Control de Enfermedades (CDC) dentro del subgrupo Ve-2 como Flavimonas por ser oxidasa negativa (característica bioquímica que la diferencia de las especies de Pseudomonas). Sin embargo, Kodama en 1985 la clasifica como Flavimonas oryzihabitans. El nombre del género está dado por su etimología, la cual corresponde a Flavus: amarillo y monas: unidad. La especie se deriva de Oryza que significa arroz; y de Habitans: que quiere decir habitan, coincidente con los numerosos aislamientos del microorganismo a partir de cultivos de arroz (10,13,14).
En abril de 1997, investigadores de la Universidad de Tokio estimaron la relación filogenética por medio de las secuencias ADNr 16S de Pseudomonas oryzihabitans con respecto a 27 especies del mismo género y se encontró homología en el 93.9% entre Flavimonas oryzihabitans y Pseudomonas aeruginosa; a partir de este estudio se sugiere utilizar el nombre de Pseudomonas oryzihabitans (15,16). Además, otros análisis filogenéticos representados en dendogramas, la han integrado por su similitud bioquímica al grupo de la Pseudomonas fluorescens y por la homología entre sus secuencias la clasifican en el grupo de Pseudomonas putida y Pseudomonas stutzeri, aunque en la actualidad la nomenclatura Flavimonas oryzihabitans es aún utilizada (15,17)
Hábitat
Su ubicación en la biosfera se relaciona principalmente con suelos, ambientes húmedos, ecosistemas naturales o artificiales, aunque este microorganismo se ha aislado de lugares donde se creería que no podría sobrevivir como en restos de petróleo, gasolina y formaldehidos, entre otros, lo cual demuestra una gran adaptación de la bacteria a ambientes hostiles. (16,18,19). Flavimonas oryzihabitans hace parte de las bacterias del grupo Ve-2 por sus constantes aislamientos del medio hospitalario y de esponjas de baño (20,21).
Este microorganismo es en particular nativo de la rizósfera del guisante (Pisum sativum L.), la mostaza india (Brassica juncea L.) y Galega orientalis. Se encuentra también en plantaciones de arroz, agua estancada, desagües, acuíferos y en agua embotellada mineral no carbonatada. Además, ha sido recuperada a partir de medios de cultivo complementados con glifosato, presentando un grado de sensibilidad a este herbicida en concentraciones mayores de 20 mM, a la cual se inhibe su crecimiento a pesar de proporcionársele glucosa como otra fuente alterna de carbono (22,23).
La Universidad Colegio Mayor de Cundinamarca cuenta con una cepa de Pseudomonas oryzihabitans aislada del agua superficial del Humedal Cintura de la cuenca del río San Jorge ubicado en el departamento de Córdoba, Colombia. Este ecosistema se encuentra localizado entre las serranías de San Jerónimo y Ayapel, zona de bosque húmedo tropical, que en la actualidad hace parte del inventario de la colección de cepas.
Características microbiológicas
Pseudomonas oryzihabitans es un bacilo Gram negativo, aerobio no fermentador, móvil por un flagelo polar, crece a temperaturas que varían entre 18°C a 42°C, es oxidasa negativa y catalasa positiva. Se cultivan bien en agar MacConkey y en agar Cetrimide, a las 24 horas de incubación produce colonias circulares con aspecto liso y brillante y miden de 0.5 mm a 1 mm de diámetro.
Después de 24 a 48 horas las colonias se tornan arrugadas de color amarillo. No producen hemólisis en agar sangre de caballo al 5%. En agares que contienen tirosina algunas cepas producen un pigmento café oscuro compatible con la melanina. En el medio de cultivo King B no presenta pigmentos fluorescentes (15-25)
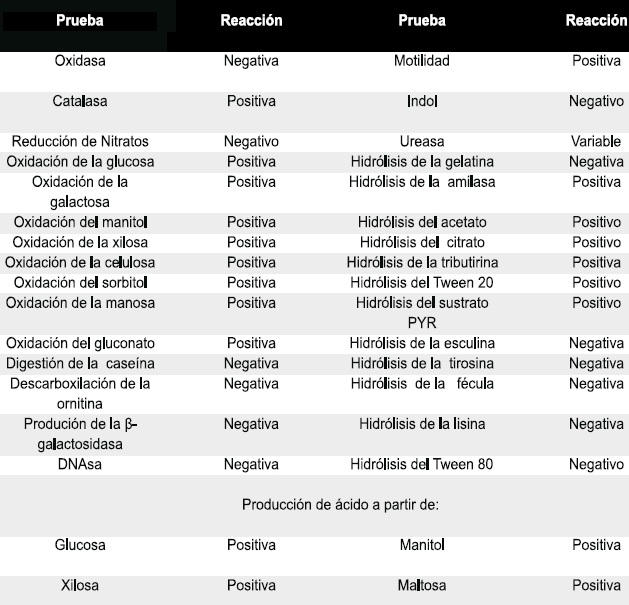
Las pruebas bioquímicas para identificación de P. orizyhabitans consisten en determinar la actividad metabólica a partir de un sustrato que se incorpora en el medio de cultivo y que la bacteria al crecer lo utiliza o no. Para realizar las pruebas bioquímicas se dispone de múltiples medios, los cuales se deben aplicar de acuerdo a las exigencias de la bacteria, Tabla 1.
Sostenibilidad in vitro
Es preciso resaltar las condiciones óptimas para la sostenibilidad microbiana in vitro de esta bacteria, debido a que en el momento de aislar las cepas éstas pueden presentar estrés en su adaptabilidad y pueden estar viables, pero no cultivables, posiblemente por las condiciones en las que se aísla y se trata. En este sentido, es importante conocer los medios que ofrecen mejores condiciones para su sostenibilidad. Los medios de cultivo para recuperar especies de Pseudomonas de ambientes acuáticos son el agar recuento en placa (PCA) y agar reducción nutricional (R2A) (25-27).
Tabla 1. Perfil bioquímico de Pseudomonas oryzihabitans.

El medio adecuado donde presenta todas sus características macroscópicas relevantes como su pigmento amarillo, es el agar infusión cerebro corazón (BHI) suplementado con 0.5% a 5% de sangre de caballo.
En lo referente a nutrientes, este microorganismo una vez logra su adaptación y desarrollo en los medios de aislamiento primario, demuestra buen crecimiento en diferentes sustratos como glucosa, arabinosa, manitol, glicerol, gluconato, acetato, sucinato, citrato, malato y lactato. Esto evidencia la asimilación de diferentes sustratos como fuente de carbono, aspecto que cobra importancia en relación con la quimiotaxis que presenta esta bacteria en la afinidad por alcanos puros como el hexadecan (23,24,26).
Patógeno intrahospitalario
Pseudomonas oryzihabitans es reconocida como patógeno nosocomial, asociada a infecciones en una gran variedad de pacientes. Se ha aislado de pacientes pediátricos que reciben ventilación mecánica y en este caso se ha identificado como del grupo Ve-2 por el CDC (28).
En niños con cáncer que tienen catéteres, en los cuales se presentaron bacteremias (29), al igual que en los que presentan erupción papular hemorrágica (30). En pacientes geriátricos e inmunocomprometidos con enfermedades de base como: neoplasias, leucemias, patologías renales y VIH positivos, también se ha identificado el microorganismo, sólo o asociado a otros, siendo causa de bacteremia, en estos casos se observa como característica común, el uso de catéteres (31,32).
También se ha encontrado en pacientes con equipos para terapia respiratoria, implantación de sondas, dispositivos para diálisis peritoneal y esponjas de baño, en los cuales se ha reportado como causa de bacteriemias y septicemias (33). De igual manera, se asocia con endocarditis, neumonías, infecciones de heridas y meningitis, especialmente en pacientes sometidos a neurocirugía; Peritonitis en pacientes sometidos a diálisis peritoneal ambulatorias sobre todo cuando llevan largo tiempo (34-36), y sinusitis tras la realización de examen endoscópico de fibra óptica en senos nasales (37).
Tras la realización de antibiogramas por la técnica de Concentración Mínima Inhibitoria (CMI), el tratamiento recomendado ha consistido en la administración de aminoglucósidos, quinolonas, cefalosporinas de tercera y cuarta generación como tazobactam, imipenem y aztreonam. Debido a que la susceptibilidad a otros agentes antimicrobianos es variable y a la misma versatilidad genética de la bacteria; se aconseja administrar ciprofloxacin como agente de elección para el tratamiento de infecciones por P. oryzihabitans (31,32). Se ha reportado que las cepas aisladas de un acuífero en Francia son sensibles también a penicilinas y aminoglucosidos (21).
Importancia en salud pública
Pseudomonas oryzihabitans se ha asociado a enfermedades de importancia en salud pública, que debido a sus condiciones puede generar emergencias en situaciones específicas de tipo ambiental o estacionaria, como precipitaciones, escorrentías, salidas de aguas subterráneas e inundaciones con asocio de material de partículas suspendidas, las cuales facilitan al microorganismo el desarrollo de biofilm, que le confiere mayor virulencia.
Este aspecto hizo necesario considerar otros métodos de desinfección como la radiación UV y la ozonización, entre otros métodos de potabilización, diferentes al proceso de cloración para la purificación del agua (16,19).
Otro factor por el cual Pseudomonas oryzihabitans se presenta con periodicidad asociado a infecciones enciertas comunidades se relaciona con la infraestructura enservicios públicos con que se cuente, ya que en países envía de desarrollo es frecuente su irrupción en los brotesinfecciosos que se presentan (19). La sociedad moderna porrazones sanitarias demanda agua mineral embotellada, quese comercializa con gran aceptación en todo el mundo. Conrespecto a este tipo de agua se deben considerar tambiénciertos factores que pueden conllevar a la producción deinfección: el primero es que contiene flora microbianaautóctona proveniente del acuífero de donde se recolecta, y que se considera de bajo riesgo para la salud. El segundofactor es el relacionado con la contaminación del acuíferodurante el procesamiento o embotellamiento.
Como consecuencia de lo anotado anteriormente se hace necesario la recolección, análisis y obtención de datos cuantitativos sobre las poblaciones de especies de Pseudomonas y bacterias relacionadas de agua mineral embotellada, como fue demostrado en un estudio realizado en Australia en el año 1998 (38). En éste estudio se utilizaron ochenta muestras de 16 marcas de agua mineral no carbonatadas provenientes de varios países que incluyeron Francia, Grecia, Australia e Indonesia, donde se encontró que el 64% de las muestras tenían Pseudomonas spp. Como bacteria predominante de la microflora del agua. A partir de este estudio se cree que estos microorganismos tienen la capacidad para sobrevivir y crecer en ecosistemas acuáticos con contenidos bajos de nutrientes.
Pseudomonas oryzihabitans se aisló sólo de la marca Corella Springs proveniente de Australia. Estos resultados llevan a considerar que existen factores que afectan la composición de la flora bacteriana como son: la geología del acuífero y sus características químicas, la tecnología que se emplea para la extracción de este recurso hídrico, el tipo y tamaño del envase, el método de almacenamiento después de embotellado y la fecha de vencimiento del agua. Los patógenos oportunistas que se aislaron en el estudio fueron P. aeruginosa, X. maltophilia, B. cepacia y
M. mesophilicum (38).
Identificación molecular y características genéticas
La caracterización de genes por técnicas de biología molecular juega un papel muy importante en la validación de la identificación microbiana y ofrece ventajas en precisión y tiempo, en comparación con otras técnicas.
Para el caso de Pseudomonas oryzihabitans, se encuentran reportados muy pocos genes en la base de datos del NCBI, y de estos sólo se encuentra la secuencia completa del gen que codifica para la región ADNr 16S, que es utilizado ampliamente en diferentes partes del mundo para la identificación de esta bacteria (10,39).
El ribosoma bacteriano está formado por dos subunidades, la grande de 50S y la pequeña 30S, cada una de éstas se encuentra compuesta por proteínas ribosómicas y moléculas de ARNr específicas. La subunidad 30S contiene el ARNr 16S y 21 proteínas numeradas desde S1 hasta S21, mientras que la subunidad 50S contiene los ARNr 5S y 23S así como las 34 proteínas designadas con la letra L (3,4). Los genes que codifican estos ARN ribosomales están organizados en operones, que corresponden a un conjunto de genes que se transcriben a partir de la misma región promotora, así cada operón contiene genes para los ARNr 23 S (rrl), 16S (rrs) y 5S (rrf ), que están separados por regiones intergénicas o separadoras que poseen genes para ARN de transferencia (ARNt) (14,16,24).
El ARNr 16S está codificado por el gen rrs, denominado también ADNr 16S. Es considerado un buen marcador molecular, a pesar de cambiar muy lentamente durante su proceso evolutivo; debido a que su estructura y función han permanecido constantes durante un tiempo muy prolongado. La cantidad de copias del operón ribosómico por genoma bacteriano varía considerablemente, de 1 a 15, siendo relativamente constante a nivel de especie, de género e incluso de familia. Se ha considerado esta secuencia como una herramienta útil para la clasificación, la taxonomía y la filogenia bacteriana (8,40,41). Se ha propuesto que los procariotas cuyo ADNr 16S tenga un 97% o más de secuencias idénticas es muy probable que pertenezcan a la misma especie.
Este argumento cobra gran importancia a la hora de identificar Pseudomonas oryzihabitans debido al alto grado de conservación, ya que las secuencias de este y de otros genes son muy semejantes entre Pseudomonas oryzihabitans y Pseudomonas putida, pero que divergen en cuanto a la expresión fenotípica (3,4,6). Por otra parte, como lo reporta la literatura, la mejor técnica es la PCR, debido a su simplicidad y bajos costos, aunque tenga el inconveniente de la baja reproducibilidad entre diferentes laboratorios. El problema se puede disminuir al realizar los experimentos en el mismo laboratorio y trabajando bajo condiciones estandarizadas (4,24,40,41).
Aplicaciones biotecnológicas
Una vez identificada la bacteria y conservada en las mejores condiciones, lo que se busca es aprovechar sus características metabólicas y de interacción con otros organismos para explotar en condiciones controladas su potencial biotecnológico en diferentes áreas como la agroambiental o la industrial.
Producción de vitamina C
La vitamina C es un derivado de una hexosa, sintetizada por las plantas a partir de la glucosa y la galactosa. El ser humano y algunas especies animales carecen de las enzimas capaces de catalizar la conversión de la glucosa en vitamina C (ácido L-ascórbico), por lo que requiere ser ingerida en la dieta. El 2,5-Diketo-D-Gluconato es un compuesto intermediario para la síntesis de vitamina C, que se puede obtener por un proceso de transformación microbiana a partir de la glucosa, las bacterias comprometidas en este proceso como Pseudomonas oryzihabitans y Pseudomonas cepacia son aisladas del suelo y de las frutas en descomposición. Se ha demostrado que estas bacterias individualmente no tienen funcionalidad, es así como en el proceso de producción de la vitamina las cepas se disponen en un cultivo mixto (42).
En el primer paso la D-glucosa es convertida a 2 DKG (2-ceto-D-gluconato) por Pseudomonas oryzihabitans, después de 48 horas cuando la biomasa alcanza el máximo, el caldo se mezcla con un volumen igual de Pseudomonas cepacia de 24 horas de crecimiento con una concentración al 1% (w/v) de glucosa. Luego el 2,5 DKG se comienza a producir, llegando a acumular el máximo después de 96 horas. Aún se desconocen las enzimas responsables de esta reacción, se cree que es acción de diferentes complejos enzimáticos.
El último paso de la reacción está descrito en base a muchas investigaciones, debido a que la actividad metabólica de P. cepacia en combinación con otros 2 DKG o diferentes sustratos, presenta la nueva posibilidad de la producción de ácido ascórbico. Lo que constituye un proceso de producción que además de emplear tecnologías limpias, hace más rentable el negocio ya que se ahorra tiempo de producción de la vitamina C, producto que ha tenido un consumo de más de 80000 toneladas en los últimos 10 años (42). La vitamina C es un derivado de una hexosa, en el caso de la síntesis de ésta por este microorganismo se realiza a partir de la glucosa y la galactosa, como fuentes de carbono y mediante la enzima la l-gulonolactona oxidasa que es capaz de catalizar la conversión de la glucosa en vitamina C.
Biocontrol
El nematodo Globodera rostochiensis afecta los cultivos de papa Solanum spp. alrededor de todo el mundo. En 1941 en Norteamérica se creó la cuarentena federal conocida como la ley del nematodo de oro, en la cual se buscaba prevenir su propagación. Cuando el suelo alcanza temperaturas superiores a 10ºC los huevos eclosionan y se hace presente la segunda etapa joven, la cual se dirige hacia las raíces de la planta huésped, luego se somete a tres mudas más para convertirse en adulto que se reproducirá sexualmente; este nematodo puede sobrevivir por más de treinta años en forma de quiste, lo cual dificulta su erradicación y hace más drásticas las pérdidas económicas. Entre las alternativas de solución empleadas; el uso de plaguicidas resulta ser la más mencionada, aunque se conozca su efecto fitotóxico y biocida especialmente en la microdiversidad nativa, problemática que puede ser suprimida gracias a la implementación de controladores biológicos como Pseudomonas oryzihabitans, bacteria capaz de colonizar las raíces de la papa en las cuales probablemente produce metabolitos secundarios que actúan contra el estadio juvenil 2 de este nematodo (26,43).
Andreoglou y colaboradores realizaron el análisis in vitro de los factores físico químicos (temperatura y humedad), en términos del potencial Matric (fuerza o presión necesaria para mover el agua verticalmente en la rizósfera) y hallaron que P. oryzihabitans ejerce un control sobre el estadio juvenil 2 de Globodera rostochiensis en las raíces de la papa. Los resultados demuestran que se necesitan temperaturas entre 21ºC y 25ºC y de un potencial matric de -0.03 MPa, para que Pseudomonas oryzihabitans se mueva rápidamente en suelos húmedos en los cuales crecen las plantas Solanum spp. y de esta forma se realice el control con éxito del nematodo. Los autores recomiendan realizar más investigaciones que permitan esclarecer la ecología de este biocontrolador en referencia a la comunidad microbiana de la que hace parte, así como el efecto de otros factores como el pH, relaciones simbióticas, textura del suelo entre otros que condicionan el proceso de control biológico, especialmente en países de producción agrícola de tipo tropical y/o subtropical (44).
Promotor de crecimiento en plantas
Las rizobacterias, promotoras del crecimiento de las plantas (PGPR), contienen la enzima 1-Aminocyclopropano- 1-carboxilato deaminasa (ACC), que hidroliza, entre otros al precursor inmediato de la hormona de etileno que al acumularse en las raíces inhibe el crecimiento de la planta, el ACC hidrolisa este precursor en a-cetobutirato y amonio, que es utilizado por las bacterias como fuente de nitrógeno. Pseudomonas oryzihabitans, aislada de las raíces del guisante Pisum sativum y de la mostaza india Brassica juncea, registró una de las más altas actividades de la ACC deaminasa, en términos de la cantidad de amonio producido, la cual fue de 890 nmoles de NH4 mg-1 por hora y demostró su capacidad para solubilizar activamente los fosfatos Ca3(PO4)2, FePO4, y C6H16O24P6Ca (45,46).
Además, se inocularon consorcios que contenían esta bacteria en diferentes suelos y lodos de un sistema de tratamiento de aguas residuales municipales provenientes de San Petersburgo, Rusia, que tenían altas concentraciones de metales pesados, para inducir las condiciones de estrés en las plantas que posteriormente fueron cultivadas. Frente a tales factores las plantas produjeron etileno, que fue hidrolizado por estas PGPRs con la consecuente elongación de las raíces. Lo cual indica que esta bacteria es capaz de inhibir la producción de etileno en la planta sometida a condiciones desfavorables, en este caso las causadas por la exposición a metales pesados, permitiendo de esta forma la elongación de sus raíces y el mejor aprovechamiento de los nutrientes en la rizósfera, consolidándose como una buena alternativa de solución al ser empleada para la mejora del crecimiento de las plantas, especialmente bajo condiciones ambientales desventajosas (46).
Sajjad y colaboradores, identificaron una bacteria aislada de la rizósfera de la hierba kallar, con capacidad para fijar nitrógeno que favorecian el crecimiento de las plantas, probablemente por la producción de una fitohormona, la bacteria fue identificada como Pseudomonas spp. por RR (gen 16S del RNA ribosomal), en asocio con otras bacterias entre las cuales la más importante pertenece al género Azospirillum (47).
Biodegradación del tolueno
Los compuestos tóxicos usados con más frecuencia son los plaguicidas, los cuales en muchos casos resultan ser muy tóxicos, aunque constituyen una adecuada fuente de carbono y donadores de electrones para ciertos microorganismos del suelo.
En el 2005 Jussila y colaboradores determinaron la diversidad genética de las bacterias cultivables de la rizósfera de Galega orientalis contaminada con aceite e hidrocarburos.
Puesto que se ha visto que en la relación simbiótica, las raíces de la planta no sólo sirven como suministro de aminoácidos, de hidratos de carbono y de ácidos orgánicos para las rizobacterias, sino que también pueden ayudarlas a degradar productos químicos y orgánicos tóxicos al permitir la liberación de fosfolípidos tensoactivos que modifican las propiedades físicas y químicas del contaminante, por ende, mejoran la biodisponibilidad. También se ha visto que los exudados de las raíces pueden crear condiciones favorables para la simbiosis (18,48).
La identificación de este microcosmos se realizó por métodos clásicos y moleculares como secuencia repetitiva basada en reacción de cadena polimerasa (rep-PCR) y por polimorfismo de longitud de fragmentos de restricción (RFLP), encontrando cuatro grandes linajes bacterianos:
Gram positivos: Rhodococcus, Bacillus y Arthrobacter y Gram negativas: Pseudomonas. En el estudio se obtuvo tan sólo una cepa de Pseudomonas oryzihabitans (H2397) que fue catecol positivo, es decir, que posee la enzima catecol 2,3-dioxigenasa, codificada por plásmidos tipo TOL, característica demostrada indirectamente al dejar caer 500 mm de catecol a las colonias cultivadas en agar extracto de levadura, si en pocos segundos se tornan amarillas, la prueba es positiva debido a la conversión de la catecol a 2- semialdehído hydroximuconico. Se demostró que esta cepa fue capaz de degradar el m-Tolueno de una manera eficiente, al crecer en un medio que contenía 13 g/L de este hidrocarburo monoaromático (48).
De igual forma se obtuvieron otras cepas de Pseudomonas oryzihabitans que a pesar de ser catecol negativas, fueroncapaces de utilizar m-Tolueno como única fuente decarbono en altas concentraciones en un rango que varia de7 a 13 g /L y lo más probable es que alberguen un plásmido TOL, que les confiera ésta característica metabólica. Esto demuestra las presiones de selección a la que son sometidas en la rizósfera, permitiendo la generación de cepas de Pseudomonas oryzihabitans con diferentes capacidades catabólicas en el proceso de la biodegradación del m-Tolueno (48).
Existe el reporte parcial de la secuencia del gen xyl ubicados en los plásmidos TOL que están estrechamente relacionados entre las especies de Pseudomonas con capacidad para metabolizar hidrocarburos y que codifican para las enzimas responsables de la composición de monocromáticos, entre ellas la catecol 2,3-dioxygenasas (C23O), encargada de la ruptura del catecol (producto de la reacción catalizada por las dioxigenasas), el cual contiene sustituyentes hidroxilos en dos carbonos adyacentes (48).
La mayoría de los plásmidos TOL identificados en algunas Pseudomonas oryzihabitans han demostrado una gran homología de secuencia de ADN al arquetipo pWW0 que se descubrió inicialmente en la cepa P. putida mt-2 aislada en el Japón en 1950. Dicho plásmido también fue identificado en una de las cinco cepas de Pseudomonas oryzihabitans, el cual se cree que fue producto de la conjugación realizada con la cepa P. putida PaW85, en la rizósfera de la planta Galega orientalis. Lo anterior demuestra que la conjugación para el paso de información genética específica puede ser un mecanismo intrínseco de las bacterias en la rizósfera para aumentar sus posibilidades de sobrevivir en suelos contaminados con petróleo.
Otro tipo de plásmido TOL el pKD1 fue identificado en dos cepas, una de las hipótesis que manejan los investigadores es que estas cepas tienen dos operones para el gen C23O, uno de ellos homólogo al gen arquotipo xylE, y la otra hipótesis es que contienen dos plásmidos pWW0 y el pDK1. Las demás cepas fueron capaces de degradar el m-tolueno, pero no se demostró que alberguen ningún tipo de plásmido Tol que le confiera dichas características metabólicas. De acuerdo con los resultados del estudio se plantea la posibilidad de utilizar Pseudomonas oryzihabitans en procesos de biorremediación de ambientes contaminados con este tipo de xenobiótico (48).
Biodegradación de pesticidas organoclorados
Debido al uso prolongado e irresponsable de pesticidas organoclorados por varias décadas, el mundo afronta hoy un problema de contaminación de agua, de suelo y de aire que repercute directamente en la salud pública. Debido a la composición química de estos insecticidas se generan interrogantes al momento de tomar decisiones sobre su degradación, ya que no hay claridad si en este proceso lo mejor es metabolizarlos a productos clorinados. Como se observa en la biodegradación aeróbica del endosulfán que a menudo da lugar a la formación de un tóxico denominado sulfato de endosulfán, que provoca efectos de tipo hematológicos, nefrotóxicos y neurotóxicos que conllevan a afecciones físicas congénitas, a retrasos mentales y a la muerte. Sin embargo, la biodegradación anaeróbica se viene considerando como otra alternativa de solución, proceso que permite mayor disponibilidad de aceptores y donadores de electrones, facilitando el ataque microbiano al compuesto tóxico bajo condiciones de reducción (48).
La gran demanda de consumo de café en el planeta, ha incentivado el desarrollo de investigaciones en diferentes áreas con el objetivo de mejorar su producción, su calidad y estabilizar los precios. Una de estas se realizó en México, en la cual investigadores lograron corroborar la acción de estas bacterias sobre los organoclorados, mediante el aislamiento de cepas de Pseudomonas oryzihabitans y Pseudomonas aeruginosa de los micronichos creados en la estructura porosa de los granos de café, cepas que han demostrado la capacidad de degradar pesticidas como el DDT (1,1,1-Tricloro-2,2-bis (4-clorofenil)-etanol) a productos como 1,1-Dicloro- 2,2´-bis (4-Clorofenil)etileno (DDE), 1-Cloro-2,2-bis (4-Clorofenil) etano (DDMU) y 2,2´-Bis (p-Clorofenil) etanol (DDOH). Estas cepas fueron evaluadas por técnicas de enriquecimiento utilizando pentacloronitrobenzeno (PCNB), un organoclorado inhibidor de hongos, como inductor de la degradación de pesticidas (49).
En el proceso se observó que las partículas de café son un soporte natural el cual permite el crecimiento bacteriano, por la alta cantidad de carbono y otros nutrientes, así que los granos de café defectuosos pueden ser usados como soporte y fuente de alimento para la biodegradación de pesticidas organoclorados, favorecido por el ambiente microaerófilo en el cual es posible producir reacciones reductoras que facilitan la degradación de compuestos tóxicos (49).
Para finalizar, y teniendo en cuenta esta revisión es importante anotar que a pesar de emplearse en la actualidad el nombre Flavimonas oryzihabitans, desde 1997 se ha descrito por medio de análisis filogenéticos de las secuencias ADNr 16S, que el nombre más propicio a utilizar es Pseudomonas oryzihabitans. La técnica más adecuada para identificar esta bacteria en sus diferentes hábitats es la PCR, debido a la rápida confirmación de los productos amplificados. El éxito de esta técnica depende de la especificidad de los primers utilizados.
El gen ADNr 16S, se constituye como un buen marcador molecular, debido a que se ha mantenido uniforme a lo largo de la evolución. Además, es el gen con el que más se ha trabajado para identificar Pseudomonas oryzihabitans (3,6,11). En los últimos años este microorganismo ha cobrado gran importancia en las investigaciones clínicas ya que últimamente esta asociado a diversas patologías de tipo nosocomial que comprometen la salud de pacientes inmunosuprimidos por múltiples razones. No sólo se trata de identificar un microorganismo, sino darle importancia a la conservación de los microorganismos nativos con el fin de aprovechar, tanto el metabolismo como otras propiedades para la aplicación en procesos biotecnológicos (50).
2. Martín A. Introducción a la microbiología del suelo: México D.F: AGT; 1980.
3. Widmer F, Seidler R, Gillevet PM, Watrud L, Di Giovanni GD. A Highly selective PCR protocol for detecting 16S rRNA genes of the genus Pseudomonas (sensu stricto) in environmental samples. Appl Environ Microbiol. 1998;64:2545–2553.
4. Ping W, Xiuting L, Musfei X, Qian Z. Characterization of efficient aerobic denitrifiers isolated from two different sequencing bactch reactors by 16S- RNAr analysis. J Biosci Bioeng. 2007;103:563-567.
5. Jeffrey E. Rapid molecular diagnosis of Lactobacillus bacteremia by terminal restriction fragment length polymorphism analysis of the 16S rRNA gene. Clin Med Res. 2004;2:37-45.
6. Laguerre G, Rigottier G, Lemanceau P. Fluorescent Pseudomonas species categorized by using polymerase chain reaction (PCR)/ restriction fragment analysis of 16S rDNA. Mol Ecol. 1994;3:479–487.
7. Kersters K, Ludwig W, Vancanneyt M, DE Vos P, Gillis M, Schleifer KH. Recent changes in classification of Pseudomonads: an overview. Syst Appl Microbiol. 1996;19:465–477.
8. Cladera AM, Bennasar A, Barceló M, Lalucat J, García E. Comparative genetic diversity of Pseudomonas stutzeri genomovars, clonal structure, and phylogeny of the species. J Bacteriol. 2004;186:5239–5248.
9. Yabuuchi E, Kosako Y, Oyaizu H, Yano I, Hotta H, Hashimoto Y, et al. Proposal of Burkholderia gen. nov. and transfer of seven species of the genus Pseudomonas homology group II to the new genus, with the type species Burkholderia cepacia (Palleroni and Holmes 1981) comb. nov. Microbiol. Immunol. 1993;36:1251–1275.
10. Kodama K, Kimura N, Komagata K. Two new species of Pseudomonas: P. oryzihabitans isolated from rice paddy and clinical specimensand P. luteola isolated from clinical specimens. Int. J Syst Bacteriol.1985;35:467–474.
11. Behrendt U, Ulrich A, Schumann P, Erler W, Burghardt J, Seyfarth W. A taxonomic study of bacteria isolated from grasses: a proposed new species Pseudomonas graminis sp. Int J Syst Bacteriol. 1999;49:297– 308.
12. Bombicino K, Almuzara MN, Famiglietti AM, Vay C. Evaluation of pyrrolidonyl arylamidase for the identification of nonfermenting Gram-negative rods. Diagn Microbiol Infect Dis. 2007;57:101-103.
13. Pien FD. Group Ve-2 (Chromobacterium typhiflavum) bacteremia. J Clin Microbiol. 1977;6:435-436.
14. Tayeb L, Ageron E, Grimont F, Grimont PA. Molecular phylogeny of the genus Pseudomonas based on rpoB sequences and application for the identification of isolates. Res Microbiol. 2005;156:763–773.
15. Holmes B, Steigerwalt AG, Weaver RE, Brenner DJ. Chryseomonas luteola comb. nov. and Flavimonas oryzihabitans gen. nov., comb. nov., Pseudomonas like species from human clinical specimens and formerlyknown, respectively, as groups Ve-1 and Ve-2. Int. J Syst Bacteriol.1987;37:245–250.
16. Anzai Y, Kudo Y, Oyaizu H.The Phylogeny of the Genera Chryseomonas, Flavimonas, and Pseudomonas supports synonymy of these threegenera. Int J Syst Bacteriol. 1997;47:249–251.
17. Willems A, Busse JM, Goor B, Pot E, Falsen E, Jantzen B, et al. Hydrogenophaga, a new genus of hydrogen-oxidizing bacteria that includes Hydrogenophaga flava comb. nov. (formerly Pseudomonas flav ). Int. J Syst Bacteriol. 1989;39:319–333.
18. Krieg N.R, Holt J.G. Bergey´s Manual of Sistematic Bacteriology. Ed. Williams y Wilkings. Baltimor, U.S.A. 1984;1:141–199.
19. Dussart L, Dupont JP, Zimmerlin I, Lacroix M, Saiter JM, Junter GA, et al. Occurrence of sessile Pseudomonas oryzihabitans from a karstified chalk aquifer. Water Res. 2003;37:1593–1600.
20. Jussila MM, Ji Z, Suominen L, Lindström K. TOL plasmid transfer during bacterial conjugation in vitro and rhizoremediation of oil compounds in vivo. Environ Pollut. 2005;146:510-524.
21. Marin M, Viedma D, Martin Rabadan P, Rodriguez Creixems M, Bouza E. Infection of hickman catheter by Pseudomonas (formerly Flavimonas) oryzihabitans traced to a synthetic bath sponge. J Clin Microbiol. 1997;38: 4577–4579.
22. Dussart J. Bodilis S, Barray N, Frebourg M, Fournier M, Duponta JP et al . Recurrent recovery of Pseudomonas oryzihabitans strains in a karstified chalk aquifer. Water Res. 2007;41:111–117.
23. Kuklinsky J, Araújo LJ, Mendes R, Kleiner AA, Azeved JL. Isolation and characterization of endophytic bacteria from soybean Glycine max grown in soil treated with glyphosate herbicide. Plant Soil. 2005;273:91–99.
24. Chaudhry HJ, Schoch PE and Cunha BA. Flavimonas oryzihabitans (CDC Group Ve-2). Infect Control Hosp Epidemiol. 1992;13:485–488.
25. Hall JA, Peirson D, Ghosh S, and Glick BR. Root elongation in various agronomic crops by the plant growth promoting rhizobacterium Pseudomonas putida GR12–2. Israel J Plant Sci. 1996;44:37–42.
26. Gilardi G, Hirschl S, Mandel M. Characteristics of yellow-pigmented nonfermentative bacilli (groups Ve-1 and Ve-2) encountered in clinical bacteriology. J Clin Microbiol. 1975;1:384-389.
27. Freney, J, Hansen W, Etienne J, Vandenesch F, Fleurette J Postoperative infant septicemia caused by Pseudomonas luteola (CDC group Ve-1) and Pseudomonas oryzihabitans (CDC Group Ve-2). J Clin Microbiol. 1988;26: 1241-1243.
28. Reina J, Odgardd J, Llompart I, Alomar P. Flavimonas oryzihabitans (formerly CDC group Ve-2) bacteremia in a pediatric patient on assistedventilation. Eur J Clin Microbiol Infect Dis. 1990;9:786-788.
29. Castagnola E, Conte M, Venzano P, Garaventa A, Viscoli C, Barretta MA, et al. Broviac catheter-related bacteraemias due to unusual pathogens in children with cancer: case reports with literature review. J Infect. 1997;34:215-218.
30. Kansouzidou A, Charitidou C, Poubrou E, Daniilidis VD, Tsagaropoulou H. Haemorrhagic papular rash associated to Flavimonas oryzihabitans bacteraemia in a child. Eur J Epidemiol. 2000;16:277-279.
31. Decker CF, Simon GL and Keiser JF. Flavimonas oryzihabitans (Pseudomonas oryzihabitans; CDC group Ve-2) bacteremia in theimmunocompromised host. Arch Intern Med.1991;151:603-604.
32. Mutters R, Koppler H, Krause T. Isolation of Flavimonas oryzihabitans (CDC group Ve-2) from catheter-induced bacteremia in an immunocompromisedpatient. Eur J Epidemiol. 1990;6:436-447.
33. Conlu A, Rothman J, Staszewski H, Schoch PE, Domenico P, Quadri SM, et al. Flavimonas oryzihabitans (CDC group Ve-2) bacteraemia associated with hickman catheters. J Hosp Infect. 1992;20:293-299.
34. Esteban J, Martin J, Ortiz A, Santos-O'Connor F, Cabria F, Reyero A. Pseudomonas oryzihabitans peritonitis in a patient on continuous ambulatoryperitoneal dialysis. Clin Microbiol Infect. 2002;8:607-618.
35. Papakonstantinou S, Dounousi E, Ioannou K, Tsouchnikas I, Kelesidis A, Nikolaos Kotzadamis, et al. A rare cause of peritonitis caused by Flavimonas oryzihabitans in continuous ambulatory peritoneal dialysis (CAPD). Int Urol Nephrol. 2005;37:433–436.
36. Levitski T, Ulian M. Peritonitis with multiple rare environmental bacteria in a patient receiving long-term peritoneal dialysis. Am J Kidney Dis. 2005;46:119-124.
37. Lejbkowicz F, Belavsky L, Kudinsky R, Gery R. Bacteremia and Sinusitis due to Flavimonas oryzihabitans) Peritonitis with multiple rare environmental bacteria in a patient receiving long-term peritoneal dialysis: Infection. Scand J Infect Dis. 2003;35:415-420.
38. Jayasekara N, Heard GM, Cox JM, Fleet GH. Populations of pseudomonads and related bacteria associated with bottled non-carbonated mineral water. Food Microbiol. 1998;15:167–176.
39. Woese CR, Blanz P, Hahn CM. What isn’t a pseudomonad: the importance of nomenclature in bacterial classification. Syst Appl Microbiol. 1984;5:179–195.
40. Darrell P, Peacock P, Aaron D, Philip E, Ann E, Chernov R, et al. Suspension array analysis of 16S rRNA from Fe- and SO4 2-reducing bacteria in uranium contaminated sediments undergoing bioremediation. Applied Environ Microbiol. 2006;28:4672–4687.
41. Hawkins RE, Moriarty RA, Lewis DE, Oldfield EC. Serious infections involving the CDC group Ve bacteria Chryseomonas luteola and Flavimonas oryzihabitans. Rev Infect Dis. 1991;13:257-260.
42. Sulo P, Hudecova D, Properova A, Basnak I, Sedlacek I.2,5-Diketo-Dgluconate production by a mixed culture of two newly-isolated strains: Flavimonas oryzihabitans and Pseudomonas cepacia. Biotechnol Lett. 2001;23:693–696.
43. Ferris H. Globodera rostochiensis. [Sitio en internet].Disponible en: http://plpnemweb.ucdavis.edu/nemaplex/Taxadata/G053S2.HTM . Consultado: 12 de febrero de 2009.
44. Andreoglou FI, Vagelas IK, Wood M, Samaliev HY, Gowen SR. Influence of temperature on the motility of Pseudomonas oryzihabitans and control of Globodera rostochiensis. Soil Biol Biochem.2003;35:1095 1101.
45. Belimov AA, Safronova VI, Sergeyeva TA, Egorova TN, Matveyeva VA, Tsyganov VE, et al. Characterization of plant growth promoting rhizobacteria isolated from polluted soils and containing 1- aminocyclopropane- 1-carboxylate deaminase. Can J Microbiol. 2001;47:642–652.
46. Glick BR, Karaturovic DM, and Newell PC. A novel procedure for rapid isolation of plant growth promoting pseudomonads. Can J Microbiol. 1995;41: 533–536.
47. Sajjad MM, Samina M, Normand P, Prigent CC, Moënne L, Bally R, et al. Molecular characterization and PCR detection of a nitrogenfixing Pseudomonas strain promoting rice growth. Biol Fertil Soils. 2006;43:163–170.
48. Jussila MM, Jurgens G, Lindström K, Suominen L. Genetic diversity of culturable bacteria in oil-contaminated rhizosphere of Galega orientalis. Environ Pollut. 2005;139:244-257.
49. Barragán BE, Costa C, Peralta J, Barrera J, Esparza F, Rodriguez R. Biodegradation of organochlorine pesticides by bacteria grown in microniches of the porous structure of green bean coffee. Int Biodeterior Biodegradation. 2007; 59:239–244.
50. Sánchez L. Evaluación de la capacidad de cinco especies de bacterias halófilas para capturar sodio in vitro. Tesis de Maestría, Universidad Militar Nueva Granada. Bogotá, D.C; 2006.