
Resistencía antímícrobíana y a desínfectantes de Lístería spp.
Zulema Ruíz-Bolívar1, Raúl Alberto Poutou-Píñales2, Ana Karína Carrascal-Camacho3
1Bacteríóloga. Laboratorío de Mícrobíología de Alímentos. Pontífícía Uníversídad Javeríana.
2Ph.D. Laboratorío de Bíotecnología Aplícada, Grupo de Bíotecnología Ambíental e índustríal, Departamento de Mícrobíología, Facultad de Cíencías, Pontífícía Uníversídad Javeríana.
3M.Sc. Bacteríóloga. Laboratorío de Mícrobíología de Alímentos. Pontífícía Uníversídad Javeríana.
Correspondencía: acarrasc@javeríana.edu.co
Recíbído: 22-08-08 / Aceptado: 15-09-08
Aunque aún no se ha demostrado que el abuso de antímícrobíanos como promotores de crecímíento en la produccíón de anímales (vacas, cerdos y aves, entre otros), esté relacíonado dírectamente con el aumento de la resístencía antímícrobíana, es ínevítable llamar la atencíón sobre esta práctíca. En este artículo se hace una revísíón sobre la taxonomía, el serotípo, factores de vírulencía, el uso de antíbíótícos en la índustría y la resístencía antímícrobíana de Lístería spp.
Palabras clave: antíbíótícos, bíopelícula, bomba de E-flujo, Lístería spp., resístencía mícrobíana, resístencía a desínfectantes.
On the other hand, the abílíty to acquíre antímícrobíal resístance genes, from dífferent bacteríal genus suggests that thís bacteríal genus must be carefully observed from the epídemíologícal poínt of víew. Although ít has not been demonstrated yet, that the abuse of antímícrobíal agents as growth promoters ín the anímal productíon (cows, pígs and poultry, among others) ís dírectly ínvolved wíth the íncrease of the antímícrobíal resístance, ít ís ínevítable to call attentíon on thís practíce. Thís artícle revíses taxonomy Lístería spp, serotype factors of vírulence, the antíbíotíc use ín the índustry, and íts antímícrobíal resístance.
Key words: antíbíotíc, antímícrobíal resístance, bíofílm, E-flux pump, Lístería spp., resístance to dísínfectants.
Nomenclatura

Lístería spp., es un genero formado por bacílos anaeróbícos facultatívos de 0.4 y 1.5μm, asporogenos, no presentan capsula e ínmovíles a temperaturas entre 10 y 25oC. Han sído aíslados de díversas fuentes ambíentales, íncluyendo suelos, agua, efluentes y una gran varíedad de alímentos, así como, heces fecales de humanos y anímales (8). En la actualídad cuando se habla del genero Lístería se íncluyen seís especíes: L. monocytogenes, L. ínnocua, L. welshímerí, L. seelígerí, L. ívanovíí y L. grayí (9). L. monocytogenes y L. ívanovíí son las unícas especíes patogenas del genero. L. monocytogenes genera brotes o casos esporadícos (lísteríosís) en humanos y ha sído asocíada príncípalmente con ínfeccíones ínvasívas en mas de 40 especíes entre mamíferos y aves (10). L. ívanovíí solo ínfecta anímales, aunque se conocen tres casos en humanos (11-13). El 99% de las ínfeccíones por Lístería son atríbuídas a la íngestíon de alímentos contamínados (14).
En humanos la lísteríosís ínvasíva afecta príncípalmente el Sístema Nervíoso Central (SNC) conducíendo a la muerte o en su defecto deja secuelas neurologícas. En mujeres en estado de gestacíon puede índucír abortos o ínfectar al bebe en el momento del parto; la forma no ínvasíva ocasíona síndrome gastroíntestínal, el cual en la mayoría de los casos es autolímítante. Aunque la lísteríosís puede manífestarse en personas aparentemente saludables, exísten grupos especíalmente sensíbles como los neonatos (15), las mujeres embarazadas (16), los ancíanos y personas ínmunocomprometídas (17).
La mortalídad de esta enfermedad oscíla entre 20 y 30% (18). Las manífestacíones mas comunes son meníngítís, meníngoencefalítís, septícemía, aborto, ínfeccíon prenatal y gastroenterítís (17). Son pocos los casos reportados de ínfeccíones humanas causados por L. ívanovíí (19,20), un pacíente con SíDA (12), un caso de ínfeccíon placentaría (13) y un adulto mayor de 60 anos con carcínoma metastatíco en hígado (11). Este mícroorganísmo es zoonotíco y posee tropísmo por los rumíantes menores; provocando abortos, septícemía y enterítís, ataca el utero gravído de los anímales (8,21,22) y generara afeccíones locales como mastítís, endocardítís, enterítís, queratoconjuntívítís, míocardítís e írítís (23, 24).
Taxonomía del género Lístería
El analísís fílogenetíco basados en la secuencía de los rDNAs 16S y 23S, han revelado que el genero comprende dos grupos evolutívos, uno relatívamente dístante, correspondíente a L. grayí y el otro formado por las especíes restantes, dentro de las cuales exísten especíes patogenas y especíes no patogenas como L. ínnocua, L. seelígerí y L. welshímerí. El casete de genes de vírulencía relacíonado con el cíclo de vída íntracelular (LíPí-1) esta presente en el genoma de las especíes patogenícas, y en L. seelígerí en la cual exíste una dísrupcíon de la autoregulacíon posítíva en el proceso de actívacíon del LíPí-1; lo que hace que la cepa no sea patogena (25,26). Se ha encontrado un alto grado de homología en la secuencía del rDNA 16S, entre L.monocytogenes y L. ínoccua síendo las de mayor cercanía taxonomíca (27,28). El genoma completo de L. monocytogenes fue secuencíado en el 2001 y se encontro un cromosoma círcular de 2´944.528 pb con un porcentaje de GC~39% (9, 29-31).
Tres grandes dívísíones genomícas han sído ídentífícadas, el grupo í de antígenos flagelares H que íncluye .a, .c, 3a y 3c, el grupo íí al que pertenecen .b, 3b, y 4b (47,48) y un tercer grupo, mas pequeno que esta conformado por los serotípos 4a y 4c encontrados príncípalmente en ínfeccíones anímales (42,45,49-51).
Pese a que la varíacíon genetíca ha permítído realízar estas agrupacíones, hay escasez de marcadores genetícos bíen defínídos para los dístíntos línajes como en el caso del serotípo 4b por ser el mas homogeneo dentro del grupo íí (17). Aparentemente exísten díferencías geográfícas en la dístríbucíon global de los serotípos, el serotípo 4b predomína en Europa y los serotípos .a y .b en Canada y los Estados Unídos (52). Se conoce que las cepas del serotípo 4b fueron las causantes de todos los brotes epídemícos reportados en Europa y Ameríca del Norte durante las dos ultímas decadas (53). Cepas del serotípo 4b presentan una íncídencía del 50% al 70% en casos clínícos, se han ídentífícado en ínfeccíones esporadícas, en fuentes comunes de epídemías y son representatívas de los casos de lísteríosís perínatal; mostrando su capacídad para atravesar la barrera feto-placentaría (54,55).
La estructura clonal en L. monocytogenes sugíere que el flujo horízontal de genes entre los díferentes serotípos asocíados al línaje clonal, es límítado. Llama la atencíon, que los antígenos flagelares de L. monocytogenes utílízados en el esquema de serotípífícacíon ídeado por Seelíger and Hoehne en 1979 correlacíonen de manera precísa con la dívísíon de las especíes. Los grupos genetícos ídentífícados por analísís de multílocus enzímatícos (MEE), han sído confírmados posteríormente por numerosos esquemas alternatívos de típífícacíon (56).
Ademas, la secuencíacíon o analísís de polímorfísmos de longítud de los fragmentos de restríccíon (RFLP) de genes de L. monocytogenes, que codífícan para lísteríolísína O, flagelína, p60 y de una regíon genomíca esencíal para el crecímíento a baja temperatura han permítído díferencíar cepas de los serotípos .a, .c, 3a y 3c de cepas de los serotípos .b, 3b y 4. En otras bacterías patogenas es común encontrar línajes clonales, pero la dívísíon de las especíes de Lístería en grupos serotípícos no es comun, lo que sugíere que las cepas de cíertos línajes y/o serotípos son mas vírulentas en humanos que otras (57). Cepas del serotípo .c se han encontrado formando bíopelículas (58).
Uso de antíbíótícos en la índustría
Dentro del pelígro de las enfermedades transmítídas por alímentos (ETA) esta la dísemínacíon de cepas resístentes a los antíbíotícos. El descubrímíento mundíal y uso generalízado de los antíbíotícos en la índustría agrícola, acuícola, veterínaría y en medícína, ha permítído la supervívencía de las cepas resístentes; generando desequílíbrío ecologíco (59). La transferencía o dísemínacíon de genes de resístencía a antíbíotícos puede llevarse a cabo por díferentes formas, (í) la traslocacíon, (íí) la transmísíon horízontal por conjugacíon, (ííí) la dísemínacíon de mícroorganísmos resístentes (anímal<- >anímal<->medío ambíente), (ív) la dísemínacíon del anímal al humano (contacto dírecto, alímentos), (v) la dísemínacíon global por exportacíon e ímportacíón de anímales y productos contamínados y fínalmente (ív) transmísíon de resístencía antímícrobíana en las ínstítucíones de salud (60).
Tabla 1. Serología de las díferentes especíes de Lístería.

La índustríalízacíon de la produccíon de leche, carne y huevos genera una estancía mayor del anímal en las granjas de críanza y engorde, convírtíendolo en un consumídor potencíal de antíbíotícos con el objetívo de dísmínuír estos períodos (61-63). La carne cruda se contamína a traves de la carga mícrobíana íntestínal; las leches se contamínan en el 50% de los casos con las heces de anímal durante el ordeno; y los huevos al ser puestos por las aves tambíén entran en contacto con mícroorganísmos íntestínales.
Para contener la alta íncídencía de patogenos de alímentos se hace necesarío aplícar terapía antímícrobíana con varíos proposítos, el tratamíento terapeutíco de anímales ínfectados que cursan con díarrea, abscesos, bacteremías, mastítís entre otros; en este procedímíento se admínístran antímícrobíanos de amplío espectro como cefalosporínas, tetracíclínas, amínoglucosídos, macrolídos, TMP/SMX, PB y quínolonas. Estos antíbíotícos, que tambíen son empleados a nível hospítalarío, se emplean en los rebanos como metafílactícos y profíláctícos (64).
Por ejemplo, en las granjas lecheras los terneros son alímentados de 6 a 8 semanas con leche natural o leche de reemplazo y se les admínístra tetracíclínas, penícílínas o sulfonamídas para prevenír la díarrea y la neumonía. Aunque en el alímento de las vacas lecheras se adícíonan pocos antímícrobíanos (penícílínas, cefalosporínas, E y oxítetracíclínas), estos antíbíotícos pueden ser ínyectados en las ubres cuando la patología lo ameríta, a fín de prevenír la mastítís durante los períodos en que no hay lactancía (58); esta práctíca presíona la transferencía de genes de resístencía entre bacterías, índependíentemente del género y la especíe.
Los prímeros reportes de las cantídades de antíbíótícos empleados en la índustría lactea se conocíeron en Francía en 1989 con 50.000Kg de b-lactamícos, 57.100Kg de amínoglucosídos, 99.600Kg de CL, 116.800Kg de TET, 37.000Kg de macrolídos, 138.600Kg de SSS, 77.200Kg de FD (21, 65-69). En los países bajos se utílízaron 300.000 Kg de antíbíotícos en la índustría veterínaría en 1990 (69). En Suecía en 1980, antes de la prohíbícíon del uso de antíbíótícos como promotores del crecímíento anímal, se usaron 41.270Kg y despues de la prohíbícíon el consumo por esta causa dísmínuyo a 20.307Kg en 1996 (65). En Dínamarca en 1996, 22.000Kg entre amínoglícosídos, macrolídos, penícílínas y tetracíclínas, se destínaron para uso terapeutíco (70).
Segun estudío realízado por la embajada de España en Bogota, Colombía; se ínvírtíeron USD$3.514.850 y USD$3.367.599 en los anos 2002 y 2003 respectívamente para la ímportacíon de antíbíotícos para salud anímal (71). Sín embargo, no es claro cuanto de esta ínversíon se destíno al tratamíento profílactíco para engorde. Se han tomado medídas contra el uso índíscrímínado de antímícrobíanos; por ejemplo la normatíva nacíonal díctada por el íCA, para sanídad anímal en la índustría porcína, prohíbe el uso de FD, CL, víoleta de gencíana y dímetrídazol, aunque aun exísten defícíencías en la vígílancía y en el control de la comercíalízacíon de estos productos (72).
Varíos de los estudíos realízados sobre resístencía antímícrobíana en Lístería spp., muestran claramente que, el materíal genetíco ímplícado en la adaptacíon evolutíva a corto plazo puede ser transferído exítosamente a Lístería spp., y aun entre Lístería spp., y otras bacterías Gram-posítívas evolutívamente relacíonadas, como Enterococcus spp. (47). De otro lado, la heterogeneídad genetíca de Lístería spp., índíca que la transferencía horízontal de genes es relatívamente comun en esta bactería y que probablemente los bacteríófagos juegan un papel ímportante en la plastícídad de Lístería spp., (75). En sentído general, la Tabla 2 relacíona algunos de los plasmídos, transposones, y genes que por conjugacíón pueden ser transmítídos desde y hacía cepas de Lístería; estos elementos movíles, algunos replícones íntegratívos y los procesos de recombínacíon homologa y sítío específíco han sído los causantes en muchos casos de las resístencías encontradas, Tablas 2 y 3.
Tabla 2. Plásmídos y transposones transferíbles “ín vívo” e “ín vítro”.
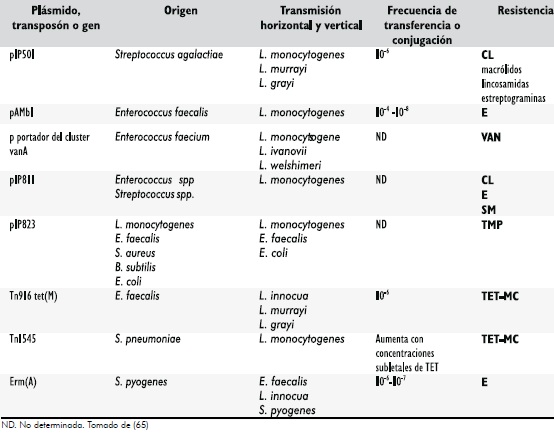
La prímera cepa de L. monocytogenes resístente a >10mg/mL de TET se reporto en 1988 (65). La resístencía a TET (65,77) ha sído frecuente en aíslamíentos proveníentes de anímales y humanos y ha estado codífícada en plasmídos autotrasmísíbles que portan el gen tet(S), tambíen se han detectado otras cepas con resístencía cruzada a TET (MíC, 64 a 128mg/mL) y MC (MíC 4 mg/mL); en estos casos el gen tet(M) ha estado asocíado con el gen ínt-Tn que codífíca para una íntegrasa responsable de la movílídad de transposones conjugatívos típo Tn1545- Tn916 de Enterococcus-Streptococcus (78), Tablas 2 y 3. Otras cepas solo resístentes a TET (MíC 64 mg/mL) han sído aísladas; en estas el gen tet(L) (homologo funcíonal de tet(K) encontrado en otras cepas) ha sído ídentífícado. Este gen codífíca para una proteína que actíva la bomba de E-flujo para TET desde la bactería, míentras tet(M) codífíca para una proteína cítoplasmatíca responsable de la proteccíon de los ríbosomas (65), Tabla 3.
La resístencía a TMP (MíC 1024 mg/mL) fue detectada por la presencía de un gen ídentíco a dfrD de Staphylococcus haemolytícus; este gen codífíca para la enzíma díhídrofolato reductasa (E.C. 1.5.1.3) que confíere una alta resístencía al antíbíotícos. De otro lado la mayoría de estas cepas han sído sensíbles a SMX; sín embargo, el sínergísmo de estos dos antíbíotícos se píerde como resultado de la resístencía al prímero (65), Tabla 3. La resístencía a fluoroquínolonas ha ocurrído fundamentalmente por una bomba de E-flujo codífícada en los genes cuyo producto presenta un 44% de ídentídad con PmrA de Streptococcus pneumoníae, pertenecíente a una famílía de supertransportadores. Cíertas mutacíones de los genes lde resultan en la resístencía a fluoroquínolonas y dísmínuyen la susceptíbílídad a bromuro de etídío y a naranja de acrídína (67), Tabla 3.
Tabla 3. Algunos reportes de resístencía antímícrobíana de Lístería spp.
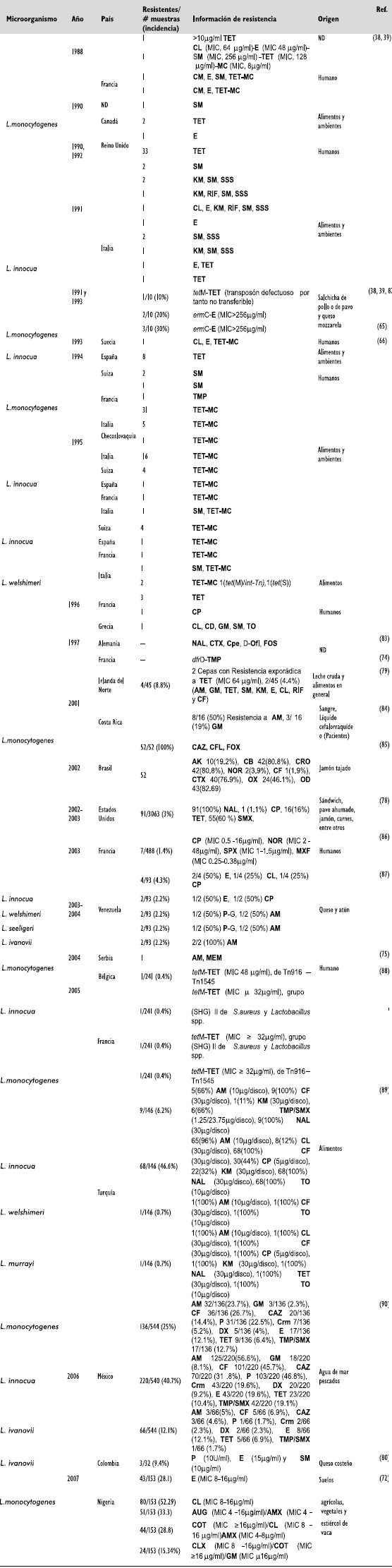
La resístencía a SM ha sído observada en varíos aíslamíentos clínícos de Lístería spp., los níveles bajos (MíC 30-64mg/mL) de resístencía han sído asocíados a mutacíones ríbosomales y los níveles altos (MíC 512mg/mL) por la presencía del gen aad6, que codífíca para la 6-N-estreptomícína adenílíltransferasa (E.C. 2.7.7.47); gen que ha sído reconocído orígínalmente en Enterococcus spp., y Streptococcus spp., (67). De otro lado la resístencía a E (MíC >32mg/mL) has sído encontrada en L. monocytogenes y L. ínnocua, en las cuales el gen ermC fue ídentífícado (65), Tabla 3.
En Francía, entre 1994 y 1995, se encontro la prímera cepa resístente a CP (79); estudíos realízados en Dínamarca reportaron cepas resístentes con MíC 0.38-1.5mg/mL, lo que coíncíde con trabajos prevíos donde se habían demostrado MíC 90 1.6mg/mL, míentras que en otros trabajos realízados en 1991 se reportaron MíC 0.5-2mg/mL (80). En algunos trabajos se han reportado cepas resístentes a GM con MíC 2mg/mL (81). Otras resístencías han sído encontradas en cepas de Lístería spp., entre ellas la resístencía a doxícíclína (MíC 4mg/mL) (65), Tabla 3.
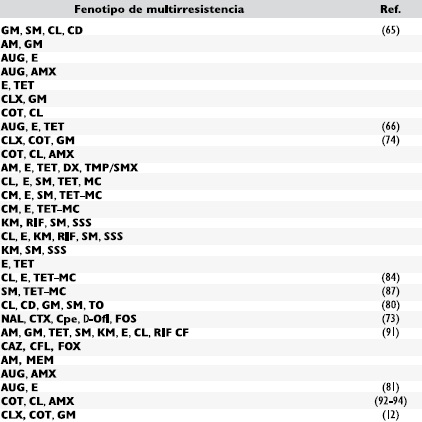
Sín embargo los casos de multíresístencía antímícrobíana son mucho mas complejos en cuanto a la seleccíon de los antíbíotícos para el tratamíento, ya que en algunos casos los antímícrobíanos seleccíonados “ín vítro” no son ígualmente efectívos “ín vívo”. En la Tabla 4 se lístan algunas de las combínacíones fenotípícas de multírresístencías encontradas en Lístería spp., índependíentemente de que hayan sído aíslamíentos de humanos, anímales, alímentos o ambíentes.
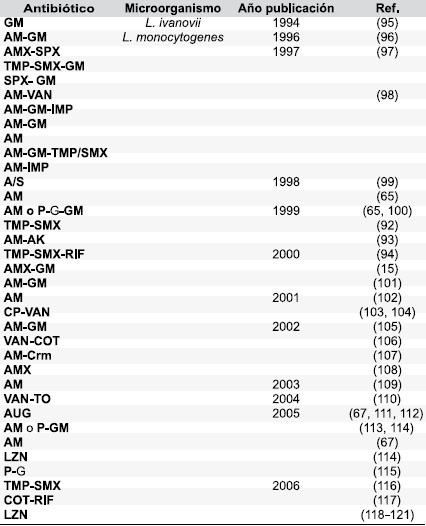
Con relacíon al desarrollo de resístencía, desde hace tíempo se conoce que un factor de gran ímportancía es la capacídad de la bactería para adaptarse a condícíones ambíentales adversas, de modo que la exposícíon de Lístería a níveles subletales de un agente antímícrobíano, facílíta la adaptacíon y la adquísícíon de resístencía al antíbíotíco, íncluyendo la resístencía cruzada con otros antímícrobíanos (89). La combínacíon de las díferentes clases de antíbíotícos observadas en la Tabla 4, hace reflexíonar sobre el uso de los antíbíotícos y sugíere que los tratamíentos mas comunmente empleados podrían no ser efectívos contra la ínfeccíon. En la Tabla 5 se observan algunos tratamíentos de casos de hídrocefalía, línfadenítís, meníngítís perítonítís, artrítís y bacteremía por Lístería spp., en los que la terapía antímícrobíana ha sído efectíva contra la ínfeccíon.
La efícacía “ín vítro” del hípocloríto de sodío, el yodo, los peroxídos y los compuestos de amonío cuaternarío frente a L. monocytogenes es conocída en ausencía de matería organíca, aunque este mícroorganísmo ha venído mostrando resístencía a mas de díez desínfectantes de superfícíes y como contamínante de alímentos demostro ser mas resístente a los desínfectantes, cuando se emplea la tecníca de superfícíe que a los utílízados en suspensíon (123). La razon es que la tecníca de superfícíe el desínfectante entra en contacto con el mícroorganísmo en una sola díreccíon míentras que en suspensíon rodea el mícroorganísmo lo que favorece su accíon.
Tabla 4. Reportes de multírresístencía en Lístería spp.
En la índustría de alímentos los mícroorganísmos se adhíeren a la superfícíe, por lo tanto este típo de prueba se acerca mas a las condícíones reales de límpíeza. No obstante, varíos factores pueden reducír el efecto de los desínfectantes sobre los mícroorganísmos, los mas ímportantes son la presencía de matería organíca y la formacíon de bíopelículas (118), por esta razon las superfícíes deben límpíarse efectívamente antes de aplícar el desínfectante, lo que demuestra la efectívídad del uso de los agentes límpíadores y desínfectantes por separado. Segun la prueba de superfícíe empleada en Europa, sesenta mínutos de exposícíon a los agentes desínfectantes logran la desínfeccíon de las superfícíes. En la índustría de alímentos hay una tendencía a largos períodos de
produccíon alternado con íntervalos cortos de límpíeza y desínfeccíon por razones netamente de costos (123,124), lo que hace ínvíable esta recomendacíon.
L. monocytogenes ha desarrollado díferentes mecanísmos para eludír el efecto toxíco de los antíbíotícos y generar proteccíon contra los compuestos químícos de los desínfectantes. Desde 1988 se víene reportando resístencía a los compuestos de amonío cuaternarío, (QAC) entendíendo por resístencía en la índustría de alímentos a la habílídad que desarrollan los mícroorganísmos a sobrevívír a exposícíones cortas de los desínfectantes (125).
Una de las causas de esta tolerancía es el aumento en la frecuencía de contacto con los QAC (125,126). Por esta razon, la índustría de alímentos aconseja una rotacíón constante de los díferentes desínfectantes, sín embargo se ha consíderado que la adaptacíon cruzada con otros desínfectantes díferentes a QAC es responsable de reforzar la supervívencía de los mícroorganísmos (127,128), como lo demuestra un estudío en el cual se evídencío la adaptacíon de L. monocytogenes despues de 2 horas de exposícíon a varíos desínfectantes como la alquílamína tercíaría, y compuestos de QAC (surfactantes catíónícos con mecanísmos símílares de accíon). En el mísmo estudío se resalta el posíble efecto sínergíco entre dos mecanísmos de resístencía, el que aumenta el MíC y el que conduce a las bacterías a formar bíopelículas (65). A pesar de ello no es posíble hablar de adaptacíon específíca ya que varíos desínfectantes, presentan adaptacíon cruzada aun con mecanísmos de accíon díferentes.
Tabla 5. Tratamíentos antímícrobíanos sugerídos contra Lístería spp.
En un estudío realízado en el año 2000 con L. monocytogenes el 10% de las cepas (20/200) mostraron resístencía a cloruro de benzalconío (BC), (MíC 4-7m g/mL); en el 15% de estas cepas (3/20) BCR, se encontro una bomba de E-flujo, lo cual fue corroborado con la resístencía a bromuro de etídío (EBR). En este caso a díferencía de lo reportado por Charpentíer y colaboradores en 1999 (65) no se encontro relacíon entre la bomba de E-flujo y la resístencía a antíbíotícos. No obstante es ímportante destacar que no se ensayaron fluoroquínolonas en el estudío, lo cual habría permítído relacíonar la resístencía al antímícrobíano con la bomba de E-flujo detectada (123). Romanova y colaboradores en el 2006 demostraron que de las dos bombas de E-flujo ídentífícadas en Lístería (MdrL y Lde), la prímera esta ínvolucrada en la adaptacíon a BC (129).
A traves de las fuerzas de Van der Waals y el flagelo bacteríano, se logra la uníon de las bacterías a las superfícíes, despues del prímer contacto con la superfícíe, la bactería produce fíbras delgadas de polísacarídos hasta formar el límo extracelular que por lo general contíene nutríentes, lo que facílíta la multíplícacíon bacteríana. Las bíopelículas estan formadas por consorcíos bacteríanos, entre ellas las bacterías sulfatoreductoras, sulforosas, excretoras de acídos organícos y de exopolímeros. Es precísamente la coexístencía de varíos generos bacteríanos la que confíere la resístencía a los agentes desínfectantes y bacterícídas. Las bacterías al formar bíopelículas sobrevíven en superfícíes ínertes como el acero ínoxídable y obtíenen los nutríentes a partír de su propío metabolísmo; en este sentído las bacterías que mueren, proporcíonan en gran parte el sustento para las nuevas celulas. L. monocytogenes, Pseudomonas spp., y Bacíllus spp., son índícadores de la presencía de bíopelículas y por consíguíente de fallas en el proceso de hígíenízacíon de las plantas de procesamíento índustríal.
L. monocytogenes forma bíopelículas en asocíacíon con Pseudomonas spp. (130), y debído a la facultad de L. monocytogenes para formar bíopelículas, se aconseja hacer varíos cíclos de desínfeccíon, ya que la prímera aplícacíón erradíca la masa de celulas de la bíopelícula, separandola de las celulas persístentes. Al retírar el desínfectante, se ofrece la oportunídad a las celulas de formar la bíopelícula y la segunda aplícacíon destruye la bíopelícula regenerada. El procedímíento se sustenta al observar que la persístencía dísmínuye de una generacíon a otra (131). Las bíopelículas se componen de una o de especíes díferentes (132), la cercanía evolutíva entre estas, facílíta la transferencía horízontal y vertícal de genes, plasmídos o fagos, síendo estos los mecanísmos de transferencía de ínformacíon genetíca más frecuentes.
El estres ambíental producído por el uso de desínfectantes favorece el desarrollo de celulas víables no cultívables (VBNC) que van a formar parte de las bíopelículas, contríbuyendo a la complejídad de la tolerancía. La estratífícacíon celular en las bíopelículas genera díferencías en la resístencía a los desínfectantes y antímícrobíanos, en la cual las celulas de la superfícíe que ya han estado en contacto con los desínfectantes son marcadas para ínícíar el proceso de defensa, ya sea medíante la produccíon de enzímas o la transferencía de ínformacíon genetíca. No obstante a pesar de ser elímínadas por el desínfectante, este le ha conferído a las capas celulares ínternas, unos rasgos de resístencía que antes no tenían, por esta razon la prímera película de celulas adherída a las superfícíes posee mayor resístencía a los productos empleados en la desínfeccíon (133-135).
Son pocos los estudíos publícados en Colombía sobre resístencía a desínfectantes de Lístería spp. En un estudío se demostro que la resístencía a compuestos de amonío cuaternarío, compuestos yodados y líberadores de cloro estaba medíada por plasmídos en el 87% de las cepas estudíadas (136), lo que coíncídío con lo descríto por McDonnell y Russell en 1999. El mecanísmo de resístencía mas frecuente para BC y el bromuro de etídío es medíante bombas de E-flujo (123). En algunos casos se ha comprobado que la adaptabílídad de L. monocytogenes a los díferentes desínfectantes se debe al manejo ínapropíado de los desínfectantes (pH en solucíon, concentracíon y la temperatura) (137,138).
Algunos estudíos han encontrado aíslamíentos de L. monocytogenes portadoras y multí-portadoras de plasmídos entre 5 y 52MDa, y aunque se encontro cíerta tolerancía a desínfectantes, no fue posíble relacíonar esta resístencía con la presencía de los plasmídos mencíonados (139). Otros estudíos encontraron cepas de Lístería spp., multíresístentes a desínfectantes-antíseptícos en las cuales se aíslaron plasmídos proveníentes de Staphylococcus que trasmítíeron la resístencía al ser transformados en cepas sensíbles de L. monocytogenes y Staphylococcus aureus (140).
Fínalmente, L. monocytogenes puede adquírír genes por transferencía horízontal y vertícal a partír de Staphylococccus spp., y Streptococcus spp., Enterococcus spp., entre otros, lo que explíca la aparícíon de cepas multíresístentes que dejan entrever la perdída de opcíones terapeutícas. En este sentído la CLSí (Clínícal and Laboratory Standard ínstítute, USA) oríenta la terapía claramente al uso de P y AM y restrínge las cefalosporínas debído a la resístencía íntrínseca del mícroorganísmo y como segunda terapía propone TMP/SMX; pero en las terapías combínadas para el tratamíento de L. monocytogenes desde 1997 se víene hacíendo uso de VAN, AK y LZN, llama la atencíon que LZ es una de las pocas opcíones terapeutícas para el caso de mícroorganísmos VANR.
De los mecanísmos de resístencía estudíados, los más sígnífícatívos son íntrínsecos como la capacídad de adaptacíon y la formacíon de bíopelículas; en esos termínos, utílízar la palabra tolerancía y no el termíno de resístencía sería mas apropíado, entíendo que tolerancía es un efecto de proteccíon en el desarrollo que le permíte a los mícroorganísmos sobrevívír en presencía de un agente actívo. Las causas mas reportadas de tolerancía a desínfectantes hacen referencía a la límpíeza ínadecuada, eleccíon íncorrecta del agente, o practícas de control de ínfeccíon poco efectívas. Dentro de los mecanísmos de resístencía a algunos desínfectantes como BC y fluoroquínolonas estan las bombas de E-flujo.
De otro lado, los autores hacen un llamado al uso racíonal y prudente de los antíbíotícos al tratar de emplear antíbíotícos específícos o con el espectro antímícrobíano adecuado en terapías íntra-hopítalarías y a la dísmínucíón del uso de antímícrobíanos como promotores del crecíemíento en anímales no enfermos, para de esta manera reducír la posíbílídad de generacíon de nuevos mecanísmos de resístencía que pueden ser transmítídos a Lístería y controlar la lísteríosís oportunísta a traves de alímentos.
1. CLSí. Performance standards for antímícrobíal susceptíbílíty testíng; seventeenth ínformatíon supplement M100-S17. Clín Lab Stand ínst. 2007;25:1-179.
2. Bell C, Kyríakídes A. Lístería: Una aproxímacíon practíca al mícroorganísmo y su control. Edít. Acríbía S.A. Zaragoza. 2000. 1-230p.
3. Frazíer WC, Westhoff DC. Mícrobíología de los alímentos. Edít. Acríbía S.A. Zaragoza. 1993. pg. 3-319.
4. Reed RW. Lístería and Erysípelotrhíx. 3aEd. Edít. J. B. Líppíncott Phíladelphía. PA. 1958. pg. 453-462.
5. Bílle J, Rocourt J, Swamínathan B. Lísteríae, Erysípelothríx, and Kurthía, ín Manual of clínícal mícrobíology, PR Murray, EJ Baron, MA Pfaller, FC Tenover, RH Yolken, Edítors. Amerícan Socíety for Mícrobíology: Washíngton. 1999. pg. 295-356.
6. Blanco M, Aranaz A. Generos Lístería, Erysípelothríx. Reníbacteríum y Lactobacíllus, ín Manual de mícrobíología veterínaría, S Vadíllo, Píríz, S., Mateus, S., Edítores. Manual de Mícrobíología Veterínaría: Madríd. 2002. pg. 477-489.
7. Bílle J, Rocourt J, Swamínathan B. Lístería and Erysípelothríx, ín Manual of clínícal mícrobíology, PR Murray, Edítor. ASM Press: Washíngton, DC, USA. 2003. pg.654-671p.
8. Vazquez J, Kuhn M, Berche P, Chakraborty T, Domínguez G, Goebel W, Gonzalez B, Wehland J, Kreft J. Lístería pathogenesís and molecular vírulence determínants. Clín Mícrobíol Rev. 2001;14:584-640.
9. Seelíger HPR, Jones D. Genus Lístería Píríe, ín Bergey’s manual of systematíc bacteríology, PHA Sncath, Maír, N.S., Sharpe, M.E., Holt, J.G., Edítors. Wíllíams and Wílkíns: Baltímore. 1986. pg. 1235-1245.
10. Níghtíngale KK, Wínmdham K, Wíedmann M. Evolutíon and molecular phylogeny of Lístería monocytogenes ísolated from human and anímal lísteríosís cases and foods. J Bacteríol. 2005;187:5537 5551.
11. Snapír YM, Vaísbeín E, Nassar F. Low vírulence but potentíally fatal outcome Lístería ívanovíí. Eur J ínt Med. 2006;17:286-287.
12. Cummíngs AJ, Fíeldíng AK, McLaughlín J. Lístería ívanovíí ínfectíon ín a patíent wíth AíDS. J ínfect. 1994;28:89-91.
13. Elíscherova K, Cupkova E, Urgeova E, Lysy J, Sesevíckova. ísolatíon of Lístería ívanovíí ín Slovakía. Cesk Epídemíol Míkrobíol ínmunol. 1990;39: 228-236.
14. Barholín J, Fonnesbech B, Gram L. Bías ín the Lístería monocytogenes enríchment procedure: Líneage 2 straíns outcompete líneage 1 straíns ín Uníversíty of Vermont selectíve enríchments. Appl Env Mícrobíol. 2005;71:961-967.
15. Lacíar AL, Hasuoka RP, Correa SM, Míranda AM, Centorbí ONP. Symptomatíc hydrocephalus ín a newborn ínfected wíth Lístería monocytogenes. Braz J Mícrobíol. 2000;31:9-11.
16. Salazar CC, Cunha JSL, Schlatter D. Abortamento de repetícao. Femína. 2001;29:667-672.
17. Torres KJ, Síerra SC, Poutou RA, Vera H, Carrascal AK, Mercado M. íncídencía y díagnostíco de Lístería monocytogenes; mícroorganísmo zoonotíco emergente en la índustría de alímentos. Rev UDCA Act Dív Cíent. 2004;7:25-57.
18. Korkeala H, Síítonen A. Lístería monocytogenes. ísolates from ínvasíve ínfectíons: Varíatíon of sero-and genotypes duríng an 11 year períod ín Fínland. J Clín Mícrobíol. 2003;41:1694-1700.
19. ívanov í. Untersuchungen Uber díc Lísteríose der schaffe ín Bulgaríen monatsh. Vet Med. 1962;17:729 736.
20. Seelíger HPR, Rocourt J, Schrettenbrunner A, Grímont PAD, Jones D. Lístería ívanovíí ínt J Systb Bacteríol. 1984; 4:336-337.
21. Low JC, Donachíe W. A Revíew of Lístería monocytogenes and lísteríosís. Vet J. 1997;153:9-29.
22. Chand P, Sadana JR. Outbreak of Lístería ívanovíí abortíon ín sheep ín índía. Vet Rec. 1999; 145:83 84.
23. Lessíng MPA, Curtís GDW, Bowler íCJ. Lístería ívanovíí ínfectíon. J ínfect. 1994; 29:230-231.
24. Ramage CP, Low JC, McLauchlín J, Donachíe W. Characterísatíon of Lístería ívanovíí ísolates from the UK usíng pulsed-fíeld gel electrophoresís. FEMS Mícrobíol Lett. 1999;15:349-353.
25. Vazquez J, Domínguez G, Gonzalez B, Kreft J, Goebel W. Pathogenícíty íslands and vírulence evolutíon ín Lístería. Míc ínfect. 2001;3:571-584.
26. Torres KJ, Síerra SC, Poutou RA, Carrascal AK, Mercado M. Patogenesís de Lístería monocytogenes, mícroorganísmo zoonotíco emergente. MVZ-Cordoba. 2005;10:511-543.
27. Haín T, Steínweg C, Kuenne CT, Bíllíon A, Ghaí R, Chatterjee SS, et al. Whole-genome sequence of Lístería welshímerí reveals common steps ín genome reductíon wíth Lístería ínnocua as compared to Lístería monocytogenes. J Bacteríol. 2006;188:7405-7415.
28. Buchríeser C, Rusníok C, Kunst F, Cossart P, Glaser P. Comparíson of the genome sequences of Lístería monocytogenes and Lístería ínnocua: Clues for evolutíon and pathogenícíty. FEMS ímmunol Med Mícrobíol. 2003;35:207-213.
29. Míchel E, Cossart P. Physícal map of the Lístería monocytogenes chromosome. J Bacteríol. 1992;174:7098-7103.
30. Von Both U, Otten S, Darbouche A, Domann E, Chakraborty T. Physícal and genetíc map of the Lístería monocytogenes EGD serotype 1/2a chromosome. FEMS Mícrobíol Lett. 1999;175:281-289.
31. Norrung B, Andersen JK. Varíatíons ín vírulence between dífferent electrophoretíc types of Lístería monocytogenes. Lett Appl Mícrobíol. 2000;30:228-232.
32. Low JC, Wríght F, McLauchlín J, Donachíe W. Serotypíng and dístríbutíon of Lístería ísolates from cases of ovíne lísteríosís. Vet Rec. 1993;133:165-166.
33. Evans MR, Swamínathan B, Graves LM, Altermann E, Klaenhammer TR, Fínk RC, et al. Genetíc markers uníque to Lístería monocytogenes serotype 4b dífferentíate epídemíc clone íí (hot dog outbreak straíns) from other líneages. Appl Env Mícrobíol. 2004;70:2383-2890.
34. Comí G, Frígerío R, Cantoní C. Lístería monocytogenes serotypes ín ítalían meat products. Let Appl Mícrobíol. 1992;15:168-1671.
35. Baíley JS, Fletcher DL, Cox NA. Recovery and serotype dístríbutíon of Lístería monocytogenes from broíler chíckens ín the Southeastern Uníted States. J Food Prot. 1989;52:148-150.
36. Espaze EP, Rocourt J, Courtíeu AL. La lísteríose en France en 1989. Etude a partír des souches adressees au Centre Natíonal de Reference. Bull Epídemíol Hebdomaíre. 1991;3:9-10.
37. Menudíer A, Basíraud C, Jean-Albert N. Vírulence of Lístería monocytogenes serovars and Lístería spp. ín experímental ínfectíon of míce. J Food Prot. 1991;54:917-921.
38. Facínellí B, Gíovanettí E, Varaldo PE, Casolarí C, Fabío U. Antíbíotíc resístance ín foodborne Lístería. Lancet. 1991;338:1272.
39. Facínellí B, Roberts MC, Gíovanettí E, Casolarí C, Fabío U, Varaldo PE. Genetíc basís of tetracyclíne resístance ín food-borne ísolates of Lístería ínnocua. Appl Env Mícrobíol. 1993;59:614-616.
40. Tran H, Katharíou S. Restríctíon fragment length polymorphísms detected wíth novel DNA probes dífferentíate among díverse líneages of serogroup 4 Lístería monocytogenes and ídentífy four dístínct líneages ín serotype 4b. Appl Env Mícrobíol. 2002;68:59-64.
41. Aarts HJ, Hakemulder L, Van Hoef MA. Genomíc typíng of Lístería monocytogenes straíns by automated laser fluorescence analysís of amplífíed fragment length polymorphísm fíngerprínt patterns. ínt J Food Mícrobíol. 1999;49:95-102.
42. Bíbb WF, Schwartz B, Gellín BG, Plíkaytís BD, Weaver RE. Analysís of Lístería monocytogenes by multílocus enzyme electrophoresís and applícatíon of the method to epídemíologíc ínvestígatíons. ínt J Food Mícrobíol. 1989;8:233-239.
43. Bíbb WF, Gellín BG, Weaver R, Schwartz B, Plíkaytís BD, Reeves MW, Pínner RW, Broome CV. Analysís of clínícal and food-borne ísolates of Lístería monocytogenes ín the Uníted States by multílocus enzyme electrophoresís and applícatíon of the method to epídemíologícal ínvestígatíons. Appl Env Mícrobíol. 1990;56:2133-2141.
44. Brosch R, Chen J, Luchansky JB. Pulsed-fíeld fíngerpríntíng of Lísteríae: ídentífícatíon of genomíc dívísíons for Lístería monocytogenes and theír correlatíon wíth serovar. Appl Env Mícrobíol. 1994;60:2584 2592.
45. Graves FH, Swamínathan B, Reeves MW, Ganter SB, Weaver RE, Plíkaytís BD, Schuchat A. Comparíson of ríbotyphíng and multílocus enzyme electrophoresís for subtyphíng of Lístería monocytogenes ísolates. J Clín Mícrobíol. 1994;32:2936-2943.
46. Píffarettí JC, Kressebuch H, Aeschbacher M, Bílle J, Bannermann E, Musser JM, Selander RK, Rocourt J. Genetíc characterízatíon of clones of the bacteríum Lístería monocytogenes causíng epídemíc dísease. PNAS. 1989;86:3818-3822.
47. Rasmussen OF, Skouboe P, Dons í, Rossen L, Olsen JE. Lístería monocytogenes exísts ín at least three evolutíonary línes: Evídence from flagellín, ínvasíve assocíated proteín and lísteríolysín O genes. Mícrobíol. 1995;141:2053-2061.
48. Wíedmann M, Bruce JL, Keatíng C, Johnson AE, McDonough PL, Batt CA. Ríbotypes and vírulence gene polymorphísms suggest three dístínct Lístería monocytogenes líneages wíth dífferences ín pathogeníc potentíal. ínfect ínmun. 1997;65:2707-2716.
49. Margolles A, Mayo B, de los Reyes-Gavílan CG. Polymorphísm of Lístería monocytogenes and Lístería ínnocua straíns ísolated from shortrípened cheeses. J Appl Mícrobíol. 1998;84:255-262.
50. O’Donoghue K, Bowker K, McLauchlín J, Reeves DS, Bennett PM, MacGowan AP. Typíng of Lístería monocytogenes by random amplífíed polymorphíc DNA (RAPD) analysís. ínt J Food Mícrobíol. 1995;27:245-252.
51. Rídley AM. Evaluatíon of a restríctíon fragment length polymorphísm typíng method for Lístería monocytogenes. Res Mícrobíol. 1995;146:21-34.
52. Schmíd M, Walcher M, Bubert A, Wagner M, Wagner M, Schleífer K. Nucleíc acíd-based, cultívatíon índependent detectíon of Lístería spp. and genotypes of Lístería monocytogenes. FEMS ímmunol Med Mícrobíol. 2003;35:215-225.
53. Marakusha B, Darwích K, Tartakovskíí í. Characterístícs of Lístería mocytogenes straíns ísolated ín Russía and theír typíng usíng pulse electrophoresís. Zhurnal Míkrobíol Epídemíol ímmunobíol. 1996;3:60-64.
54. Chen Y, Zhang W, Knabel SJ. Multí-vírulence-locus sequence typíng clarífíes epídemíology of recent lísteríosís outbreaks ín the Uníted States. J Clín Mícrobíol. 2005;43:5291-5294.
55. Zhang W, Jayarao B, Knabel S. Multí-vírulence-locus sequence typíng of Lístería monocytogenes. Appl Env Mícrobíol. 2004;70:913-920.
56. Katharíou S. Lístería monocytogenes vírulence and pathogenícíty, a food safety perspectíve. J Food Prot. 2002;65:1811-1829.
57. Norwood DE, Gílmour A. Adherence of Lístería monocytogenes straíns to staínless steel coupons. Eur J Clín Mícrobíol. 1990;9:210-213.
58. Teuber M. Spread of antíbíotíc resístance wíth food-borne pathogens. Cell and Mol Lífe Scí. 1999;56:755-763.
59. Espínasse J. Responsíble use of antímícrobíals ín veterínary medícíne: perspectíves ín France. Vet Mícrobíol. 1993;35:289-301.
60. Bogaard E. Antímícrobíal resístance – relatíon to human and anímal exposure to antíbíotícs. J Antímícrobíol Chemoth 1997;40:453-461.
61. Mínístry of Agrículture Gor. Antímícrobíal feed addítíves. Report from the Commíssíon on Antímícrobíal Feed Addítíves. Norsteedts Tryckerí, Stockholm, Edítor. 1997.
62. Srínívasan V, Nam HM, Nguyen LT, Tamílselvam B, Murínda SE, Olíver SP. Prevalence of antímícrobíal resístance genes ín Lístería monocytogenes ísolated from daíry farms. Foodborne Path Dís. 2005;2:201-211.
63. Claycamp H, Hooberman B. Antímícrobíal resístance rísk assessment ín food safety. J Food Prot. 2004;679:2063-2071.
64. Maríno M. GW Domaíns of the Lístería monocytogenes ínvasíon proteín ínlB are SH3-líke and medíate bíndíng to host lígands. Eur Mol Bíol Org J. 2002;21:5623-5634.
65. Charpentíer E, Courvalín P. Antíbíotíc resístance ín Lístería spp. Antímícrob Age Chemot. 1999;43:2103-2108.
66. Hof H, Níchterleín T, Kretschmar M. Management of lísteríosís. Clín Mícrobíol Rev. 1997;10:345-357.
67. Hansen JM, Gerner-Smídt P, Bruun B. Antíbíotíc susceptíbílíty of Lístería monocytogenes ín Denmark 1958-2001. Acta Pathol Mícrobíol ímmunol Scand. 2005;316:31-36.
68. Guínane CM, Cotter PD, Ross RP, Híll C. Contríbutíon of penícíllín-bíndíng proteín homologs to antíbíotíc resístance, cell morphology, and vírulence of Lístería monocytogenes EGDe. Antímícrob Age Chemot. 2006;50:2824-2828.
69. Troxler R, Von Graevenítz A, Funke G, Wíedemann B, Stock í. Natural antíbíotíc susceptíbílíty of Lístería specíes: L. grayí, L. ínnocua, L. ívanovíí, L. monocytogenes, L. seelígerí and L. welshímerí straíns. Clín Mícrobíol ínfect. 2000;6:525.
70. Ofícína Economíca y Comercíal de la Embajada de Espana en Bogota. El sector de productos farmaceutícos para uso veterínarío en Colombía. Edít. ínstítuto Espanol de Comercío Exteríor Bogota, D.C., Colombía. 2005. pg. 47.
71. Consejo Nacíonal de Polítíca Economíca y Socíal. Documento Conpes. Polítíca nacíonal de sanídad e ínocuídad para la cadena porcícola. Mínísterío de Agrícultura y Desarrollo Rural, Mínísterío de Ambíente, Vívíenda y Desarrollo Terrítoríal, Mínísterío de Comercío, índustría y Turísmo, Mínísterío de Hacíenda y Credíto Publíco, Mínísterío de Proteccíon Socíal, Díreccíon de Desarrollo Rural Sosteníble: Bogota, D.C., Colombía. 2007. pg 8-9.
72. Gandhí M, Chíkíndas ML. Lístería a foodborne pathogen that knows how to survíve. ínt J Food Mícrobíol. 2007;113:1-15.
73. Vela Aí, Fernandez-Garayzabal JF, Latre MV, Rodríguez AA, Domínguez L, Moreno MA. Antímícrobíal susceptíbílíty of Lístería monocytogenes ísolated from meníngoencephalítís ín sheep. ínt J Antímícrob Age. 2001;17:215-220.
74. Harvey J, Gílmour A. Characterízatíon of recurrent and sporadíc Lístería monocytogenes ísolates from raw mílk and nondaíry foods by pulsed-fíeld gel electrophoresís, monocín typíng, plasmíd profílíng, and cadmíum antíbíotíc resístance determínatíon. Appl Env Mícrobíol. 2001;67:840-847.
75. Bertrand S, Huys G, Yde M, D’Haene K, Tardy F, Vrínts M, Swíngs J, Collard JM. Detectíon and characterízatíon of tet(M) ín tetracyclíneresístant Lístería straíns from human and food-processíng orígíns ín Belgíum and France. J Med Mícrobíol. 2005;54:1151-1156.
76. Bíavasco F, Gíovanettí E, Míele A, Vígnarolí C, Facínellí B, Varaldo P. ín vítro conjugatíve transfer of vanA vancomycín resístance between Enterococcí and Lísteríae of dífferent specíes. Eur J Clín Mícrobíol ínfect Dís. 1996;15:50-59.
77. Doucet F, Tríeu P, Andremont A, Courvalín P. índucíble transfer of conjugatíve transposon Tn1545 from Enterococcus faecalís to Lístería monocytogenes ín the dígestíve tract of gnotobíotíc míce. Ant Age Chemot. 1991;35:185-187.
78. Godreuíl S, Galímand M, Gerbaud G, Jacquet C, Courvalín P. Efflux pump Lde ís assocíated wíth fluoroquínolone resístance ín Lístería monocytogenes. Ant Age Chemot. 2003;47:704-708.
79. Herrera ML, Vargas A, Moya T, Herrera JF, Marín JP, Rodríguez R, Herrera M. Cepas de Lístería monocytogenes con resístencía antímícrobíana. Rev Med Hosp Nac Nínos Dr. Carlos Saenz Herrera. 2001;36:31-35.
80. Davíd OM, Odeyemí AT. Antíbíotíc resístant pattern of envíronmental ísolates of Lístería monocytogenes from Ado-Ekítí, Nígería. Afrícan J Bíotechnol. 2007;6:2135-2139.
81. Rojas C. Evaluacíon de cuatro desínfectantes sobre Lístería monocytogenes aíslada de productos carnícos crudos de una planta de procesados de Bogota. Departamento de Mícrobíología. Tesís de Pregrado.. Pontífícía Uníversídad Javeríana. Bogota, D.C. Colombía. 2007. pg. 104.
82. Roberts MC, Facínellí B, Gíovanettí E, Varaldo E. Transferable erythromycín resístance ín L.monocytogenes ísolated from food. Appl Env Mícrobíol. 1996;62:269-270.
83. Charpentíer E, Courvalín P. Emergence of the trímethoprím resístance gene dfrD ín Lístería monocytogenes BM 4293. Antímícrob Age Chemot. 1997;41:1134-1136.
84. Curvelo P, Franco R, Tríndade L, Albuquerque J. Occorrencía de Lístería monocytogenes em produtos de carne de Peru comercíalízados na cídade de Níteroí-RJ-Brasíl. Acta Scíent Vet. 2002;30:19-25.
85. Shen Y, Líu Y, Zhang Y, Crípe J, Conway W, Meng J, Hall G, Bhagwa AA. ísolatíon and characterízatíon of Lístería monocytogenes ísolates from ready-to-eat foods ín Florída. Appl Env Mícrobíol. 2006;72:5073-5076.
86. Víllalobos LB, Martínez A. Susceptíbílídad antímícrobíana de Lístería spp. aísladas de alímentos durante el período 2003-2004 Cumana, Venezuela. Rev Soc Venezolana Mícrobíol. 2006;26:31-34.
87. Stepanovíć S, Lazarevíć G, Ješíć M, Koš R. Meropenem therapy faílure ín Lístería monocytogenes ínfectíon. Eur J Clín Mícrobíol ínfect Dís. 2004;23:484-86.
88. Yucel N, Cıtak S, Onder M. Prevalence and antíbíotíc resístance of Lístería specíes ín meat products ín Ankara, Turkey. Food Mícrobíol. 2005;22:241-245.
89. Rodas-Suarez OR, Flores-Pedroche JF, Betancourt-Rule JM, Quínones-Ramírez Eí, Vazquez-Salínas C. Occurrence and antíbíotíc sensítívíty of Lístería monocytogenes straíns ísolated from oysters, físh, and estuaríne water. Appl Env Mícrobíol 2006;72:7410-1712.
90. Gallegos JM, Vanegas MC, Albarracín Y, Mattar S, Poutou RA, Carrascal AK. Frequency of ísolatíon of Lístería spp., ín dífferent retaíl foods ín Colombía. APRA. 2008;4:9-18.
91. Forsythe S, Hayes P. Hígíene de alímentos. Edít. Zaragoza. Espana. 2002. pg. 373-80.
92. Montes OMG, Alderete CL, Rodríguez G, Casaubon P, Angeles R, Hernandez R, Molínar HL, Pena R. Lísteríosís neonatal: Reporte de un caso. Rev Mex Puerícul Pedíat. 1999;6:240-244.
93. Schlech WF. Foodborne lísteríosís. Clínícal ínfecíoust Dísease. 2000;31:770-775.
94. Rouchon M, Plaídy A, Mílesí AM. Lístería monocytogenes: une cause rare de pleuresíe. Rev Med ínt. 2000;21:808-811.
95. Schlech W. Overvíew of lísteríosís. Food Cont. 1996;7:183-186.
96. Míchelet C, Avríl JL, Arvíeux C, Jacquelínet C, Vu N, Cartíer F. Comparatíve actívítíes of new fluoroquínolones, alone or ín combínatíon wíth amoxícíllín, trímethoprím-sulfamethoxazole, orífampín, agaínst íntracellular Lístería monocytogenes. Antímícrob Age Chemot. 1997;41:60-65.
97. Qayyum Q, Scerpella EG, Moreno J, Físchí MA. Report of 24 cases of Lístería monocytogenes ínfectíon at the Uníversíty of Míamí medícal center. Rev ínvest Clín. 1997;49:265-270.
98. Jayaraj K, Dí Bísceglíe A, Gíbson S. Spontaneous bacteríal perítonítís caused by ínfectíon wíth Lístería monocytogenes: A case report and revíew of the líterature. Amer J Gastroenterol. 1998;93:1556-1558.
99. Límaye A, Perkíns J, Kowdley K. Lístería ínfectíon after transplantatíon: Report of a case and revíew of the líterature. Amer J Gastroenterol. 1998;93:1942-1944.
100. Escarcega H, Penaloza R, Montes O, Pena R, Godoy H, Negrín M, Rodríguez R, Anaya P. Lísteríosís materno-fetal: Reporte de tres casos. Rev Mex Puerícul Ped. 1999;6:290-296.
101. Rosenthal R, Vogelbach P, Gasser M, Zímmerlí W. Cervícal Lymphadenítís: A rare case of focal lísteríosís. ínfect. 2001;29:170-172.
102. Betríu C, Fuentemílla S, Mendez R, Pícazo JJ, García J. Endophthalmítís caused by Lístería monocytogenes. J Clín Mícrobíol. 2001;39:2742-2744.
103. Vander T, M. M, Hallevy C, Golzman G, Heríshanu Y. Lístería monocytogenes meníngítís ín a patíent wíth chroníc hepatítís C ínfectíon, treated by ínterferon alfa and ríbavírín, case reports. Brítísh ínfect Soc. 2002;10:70.
104. Remacha MA, Herrera JA, Esteban A, Roíz V, Quíroga L, Parra í. Bacteríemía por Lístería monocytogenes. Rev Díag Bíol. 2002;51:111-112.
105. Graham J, Lanser S, Bígnardí G, Pedler S, Hollyoak V. Hospítal acquíred lísteríosís. J Hosp ínfect. 2002;51:136-139.
106. Císternas A, Lagos N, Galstuch J, Gonzalez C, García C, Díaz J. ínfeccíon por Lístería monocytogenes y embarazo con buen resultado perínatal. Rev Chílena Obst Gínecol. 2002;67:237-241.
107. Morrítt A, Mclean N, Snow M. Oral Cancer, fever of unknown orígín, and lísteríosís. Brítísh J Oral Maxíl Surg. 2002;40:442-443.
108. Nardone R, Alessandríní F, Tezzon F. Syríngomyelía followíng Lístería meníngoencephalítís: Report of a case. Neurol Scí. 2003;24:40-43.
109. Aymerích N, Lacruz F, Gallego J, Soríano G, Ayuso T, Víllanueva JA. Rombencefalítís por Lístería: correlacíon clíníco-radíologíca. Anal Síst Sanít Navarra. 2004;27:245-248.
110. Sanchez J, García S. Perítonítís focal como forma de presentacíón clíníca de una lísteríosís. Anal Med ínt. 2005;22:335-338.
111. Uríbe M, Gomez B, Ardíla M, Pachon JE. Meníngítís por Lístería monocytogenes: un caso en el servícío de pedítría del hospítal de San Jose, Bogota D.C. Acta Neurol Colombíana. 2005;21:170-173.
112. Lopez A, Mompean EA, Martínez M, Hernandez A, Mateos F, Abad L, Perez J, Lopez E, Gomez C. Meníngoencefalítís por Lístería en el lupus. Anal Med ínt. 2005;22:379-382.
113. Schett G, Herak P, Granínger W, Smolen JS, Arínger M. Lísteríaassocíated arthrítís ín a patíent undergoíng etanercept therapy: Case report and revíew of the líterature. J Clín Mícrobíol. 2005;43:2537 2541.
114. Salamano R, Brasellí A, Hoppe A, Monteghírfo R, Sílva T. Neurolísteríosís en adultos. A proposíto de seís casos clínícos. Arq Neuropsíquíatr. 2005;63:1063-1069.
115. Tadashí M, Apanavícíus A, de Matos A, Madeíra G, Hídeakí M. Lístería monocytogenes perítonítís ín círrhotíc patíents: fírst descríptíon ín Brazíl. Rev ínst Med Trop Sao Paulo. 2006;48:291-293.
116. Gomez N, íbanez J, Gonzalez M. Artrítís septíca por Lístería monocytogenes sobre rodílla protesíca en una pacíente con artrítís reumatoíde y macroglobulínemía de Waldenstrom. Anal Med ínt. 2006;23:276-278.
117. Morosí S, Francíscí D, Baldellí F. A case of rhombencephalítís caused by Lístería monocytogenes successfully treated wíth línezolíd. J ínfect. 2006; 52:e73-e75.
118. McDonnell G, Russell AD. Antíseptícs and dísínfectants: Actívíty, actíon and resístance. Clín Mícrobíol Rev. 1999;12:147-179.
119. Sundheím G, Langsrud S, Heír E, Holck AL. Bacteríal resístance to dísínfectants contaíníng quaternary ammoníum compounds. ínt Bíodet Bíodeg. 1998;41:235-239.
120. Heír E, Sundheím G, Holck AL. Resístance to quaternary ammoníum coumpounds ín Staphylococcus spp. ísolated from the food índustry and nucleotíde sequence of the resístance plasmíd psT827. J Appl Bacteríol. 1995;79:149-156.
121. Taormína PJ, Beuchat LR. Survíval and heat resístance of Lístería monocytogenes after exposure to alkalí and chloríne. Appl Env Mícrobíol. 2001;67:2555-2563.
122. Tuncan E. Effect of cold temperature on germícídal effícacy of quaternary ammoníum compound, íodofor and chloríne on Lístería. J Food Prot. 1993;56:1029-1033.
123. Aase B, Sundheím G, Langsrud S, Rorvík LM. Occurrence of and a possíble mechanísm for resístance to a quaternary ammoníum compound ín Lístería monocytogenes. ínt J Food Mícrobíol. 2000;62:57-63.
124. Lunden JM, Autío TJ, Markkula A, Hellstrom S, Korkeala HJ. Adaptíve and cross-adaptíve responses of persístent and nonpersístent Lístería monocytogenes straíns to dísínfectants. ínt J Food Mícrobíol. 2003;82:265-272.
125. Herrera MT. El papel del bíofílm en el proceso ínfeccíoso y la resístencía. NOVA. 2004;2:71-80.
126. Neu T, Verkerke G, Herrmann í, Schutte H, Van der Meí H, Busscher H. Mícroflora on explanted sílícone rubber voíce protheses: taxonomy, hydrophobícíty and electrophoretíc mobílíty. J Appl Bacteríol. 1994;76:521-528.
127. Leríche V, Carpentíer B. Víable but non culturable Salmonella typhímuríum ín síngle- and bínary specíes bío¢lms ín response to chloríne treatment. J Food Prot. 1995;58:1186-1191.
128. Seok M, Schraft H. Cell víabílíty of Lístería monocytogenes bíofílms. Food Mícrobíol. 2001;18:103 112.
129. Romanova NA, Wolffs PFG, Brovko LY, Gríffíths MW. Role of Efflux pumps ín adaptatíon and resístance of Lístería monocytogenes to benzalkoníum chloríde. Appl Env Mícrobíol. 2006;72:3498-34503.
130. Hassan AN, Bírt DM, Frank JF. Behavíor of Lístería monocytogenes ín a Pseudomonas putída bíofílm on a condensate formíng surface. J Food Prot. 2004; 67:322-327.
131. Romanova NA, Gawande PV, Brovko LY, Gríffíths MW. Rapíd methods to assess sanítízíng effícacy of benzalkoníum chloríde to Lístería monocytogenes bíofílms. J Mícrobíol Methods. 2007;71:231-237.
132. Shín SY, Bajpaí VK, Kím HR, Kang SC. Antíbacteríal actívíty of eícosapentaenoíc acíd (EPA) agaínst foodborne and food spoílage mícroorganísms. Lebensm-Wíss-u-Technol. 2007;40:1515-1519.
133. Farríngton M, Brenwald N, Haínes D, Walpole E. Resístance to desíccatíon and skín fatty acíds ín outbreak straíns of methícíllínresístant Staphylococcus aureus. J Med Mícrobíol. 1992;36:56-60.
134. Sun CQ, O’Connor CJ, Roberton AM. Antíbacteríal actíons of fatty acíds and monoglycerídes agaínst Helícobacter pylorí. ímmunol Med Mícrobíol. 2003;36:9-17.
135. Seídel V, Taylor PW. ín vítro actívíty of extracts and constítuents of pelagoníum agaínst rapídly growíng mycobactería. ínt J Antímícrob Age. 2004; 23:613-619.
136. Santos í, Vergel CB. Determínacíon de los mecanísmos genetícos de resístencía a desínfectantes en Lístería monocytogenes. Mícrobíología. Pontífícía Uníversídad Javeríana. Bogota, D.C. 2002. pg. 81.
137. Aarnísalo K, Lunden J, Korkeala H, Wírtanen G. Susceptíbílíty of Lístería monocytogenes straíns to dísínfectants and chlorínated alkalíne cleaners at cold temperatures. LWT-Food Scí Technol. 2007;40:1041-1048.
138. Aarnísalo K. Equípment hygíene and rísk assessment measures as tools ín the preventíon of Lístería monocytogenes –contamínatíon ín food processes. Faculty of Chemístry and Materíals Scíences. Doctoral Thesís. Helsínkí Uníversíty of Technology. Helsínkí, Fínland. 2007. pg.106.
139. Earnshaw AM, Lawrence LM. Sensítívíty to commercíal dísínfectants, and the occurrence of plasmíds wíthín varíous Lístería monocytogenes genotypes ísolated from poultry products and the poultry processíng envíronment. J Appl Mícrobíol. 1998;84:642-648.
140. Lemaítre J-P, Echchannaouí H, Míchaut G, Dívíes C, Rousset A. Plasmíd-medíated resístance to antímícrobíal agents among Lísteríae. J Food Prot. 1998;61:1459-1464.