Mitocondria y muerte celular
Ruth Sánchez1,2,3; Gonzalo Arboleda1,4
1Grupo de Neurociencias, Facultad de Medicina, Universidad Nacional de Colombia.
2Biotecnología, Universidad Nacional de Colombia.
3Universidad Colegio Mayor de Cundinamarca, Colombia.
4Departamento de Patología, Facultad de Medicina, Universidad Nacional de Colombia.
Correspondencia: rmsanchezm@unal.edu.co
Recibido: 20-08-08 /Aceptado: 25-09-08
Resumen
Recientemente se ha definido el papel decisivo que tienen las mitocondrias en los mecanismos de muerte celular, los cuales se han explicado en diversos modelos, donde la permeabilización de la membrana externa mitocondrial y la liberación de proteínas importantes del espacio intermembranal de la mitocondria son características importantes que definen este proceso. Específicamente proteínas pro-apoptóticas tales como Citocromo c, Smac/diablo entre otras, son liberadas durante estadios tempranos del proceso apoptótico. Los mecanismos por los cuales estas proteínas son liberadas dependen presumiblemente del tipo celular y la naturaleza del estímulo. La activación de las caspasas (proteasas de cisteína) durante la apoptosis temprana parece estar regulada principalmente por la familia de las proteínas Bcl-2, cuya función principal es el control de la permeabilidad de la membrana mitocondrial a través de la formación o regulación de poros, en particular el poro de permeabilidad transicional mitocondrial. La presente revisión busca mostrar una visión global del papel de la mitocondria en los procesos de muerte celular, en la apoptosis, y en algunos de los mecanismos moleculares involucrados en su regulación.
Palabras clave: apoptosis, caspasas, citocromo c, ciclo de Krebs, glucólisis, mitocondria.
Abstract
Mitochondria and cell death Recently the decisive role of mitochondria in the mechanisms of cell death has been defined in diverse models, where the permeability of the mitochondrial outer membrane and the important protein release of the intermembrane space of mitochondria are important characteristics that define this process. Specifically pro-apoptosis proteins such as Cytochrome c, Smac/devil among others, are released during early stages of the apoptosis process. The mechanisms by which these proteins are released depend presumably on the cell type and the nature of the stimulus. The activation of caspases (proteases of cysteine) during the early apoptosis seems to mainly be regulated by the family of the Bcl-2 proteins, whose main function is the control of the permeability of the mitochondrial membrane through the formation or regulation of pores, in particular the pore of mitochondrial transitional permeability. This revision intends to show a global vision of the role of mitochondria in the processes of cell death, in apoptosis and in some of the molecular mechanisms involved in its regulation.
Key Words: apoptosis, caspases, cytochrome c, glycolysis, Krebs cycle, mitochondria.
Introducción
Hasta hace poco tiempo se consideraba que la principal funcion de la mitocondria estaba limitada a la producción de energia en forma de ATP. Sin embargo, se ha descrito un nuevo papel para este organelo dentro del proceso de la muerte celular programada (Apoptosis), actuando de reservorio de proteínas apoptoticas como el citocromo C, Smac / Diablo, el factor inductor de apoptosis, (AIF), endonucleasa G y las procaspasas 2,3,8 y 9 (1). La liberacion de estas proteínas conduce a una secuencia de cambios morfológicos que van desde la condensación nuclear hasta la exposición de la fosfatidilserina y de moléculas de adhesión en la superficie de las células que han entrado en apoptosis (2).
Por tanto, parece que la mitocondria actua como el escenario integrador de una cadena de estimulos inductores para la apoptosis y desencadena una serie de cascadas de senalizacion que terminan con la muerte de la celula. Los avances en este campo han generado nuevas preguntas a cerca de las funciones y mecanismos regulatorios de este proceso, entre las que se incluyen, .como controla la familia Bcl-2 la liberacion de proteinas de la mitocondria?, .que papel juega el poro de permeabilidad transicional mitocondrial? (del ingles, mitocondrial permeability transition pore mPTP), entre otros.
Mitocondria: aspectos estructurales y fisiológicos
Generalidades
La mitocondria se conoce desde hace más de un siglo y en su historia se encuentra el trabajo de cientos de investigadores de distintas disciplinas e intereses. El primero en describir las mitocondrias fue R. Atman en 1884; las identifico como unas estructuras intracelulares a las que llamo mioblastos. Anos despues, Benda denomino a esas estructuras mitocondrias, del griego mitos que significa hilo y condos granulo. Las mitocondrias son organelos intracelulares presentes en practicamente todas las células eucariotas. Estan encargados de suministrar la mayor parte de la energia necesaria para la actividad celular, sintetizan ATP a expensas de glucosa, acidos grasos y aminoácidos por medio de la fosforilacion oxidativa (3).
La mitocondria tiene un tamaño variable entre 0.1μm y 0.5μm de diámetro y pueden alcanzar una longitud máxima de 7μm, sin embargo este depende de la actividad de la célula (4). En promedio hay unas 2000 mitocondrias por célula, pero las que desarrollan mayor actividad metabólica, como las musculares, tienen un número mayor en comparación con las poco activas, por ejemplo las células epiteliales (5).
Aspectos estructurales
La mitocondria posee un sistema de doble membrana una externa y una interna, que separan tres espacios bien definidos: el citosol, el espacio intermembranal y la matriz mitocondrial. Las membranas mitocondriales se caracterizan por bajos niveles de ciertos lipidos como el acido fosfatidico, las esfingomielinas y los glicolipidos caracteristicos de las membranas de las celulas eucariotas.
Presenta un bajo porcentaje de colesterol entre el 7%- 11% en comparacion con la membrana de una celula (25%-34%) (4). El alto contenido de fosfatidilcolina, fosfatidilinositol, cardiolipinas y la escasa cantidad de fosfatidilserina, hacen que la membrana mitocondrial sea semejante a las membranas de ciertas bacterias.
Al igual que las membranas plasmaticas, las mitocondriales poseen una simetria en la distribucion de los lipidos no solo entre las membranas interna y externa, sino tambien entre las capas interna y externa de la bicapa lipidica. De modo que una alteracion en esta distribución tiene consecuencias para la funcion y supervivencia de las mitocondrias y aun de la celula misma en el proceso de la apoptosis (6,7).
La membrana externa es una bicapa lipidica, continua, uniforme y esta constituida por 40% de lipidos y 60% de proteinas que forman poros, llamados porinas o canales aniónicos dependientes de voltaje (del inglés voltage dependent anion channel: VDAC) que la hacen permeable a iones, metabolitos y muchos polipéptidos (7). Esto asegura el paso, por transporte pasivo, de moléculas citosólicas de peso molecular igual o inferior a 10.000 Da y un diámetro aproximado de 20 Å. Tambien posee enzimas que convierten sustratos lipidicos en formas que van a ser subsecuentemente metabolizadas en la matriz, como por ejemplo la esfingomielinasa que se encarga de metabolizar la esfingomielina (4).36
La membrana externa posee receptores de importación capaces de reconocer secuencias de direccionamiento de las proteinas citosolicas destinadas a las mitocondrias, por ejemplo las ADN y ARN polimerasas mitocondriales.
Tambien se observan elementos de translocacion de proteinas o de complejos de importacion sintetizados en el citoplasma. En el momento de la importacion de una proteina estos complejos se asocian temporalmente a los complejos de importacion de la membrana interna y de esta forma las membranas externa e interna quedan temporalmente unidas (4). Otros complejos favorecen la importacion del colesterol, que es necesario para la sintesis de esteroides desarrollados en la mitocondria. Ademas, la membrana externa posee proteinas que pueden establecer, junto con la actina, uniones dependientes de ATP y proteinas antiapoptoticas de la familia Bcl-2, cuya sobre expresion tiene como consecuencia el bloqueo de la apoptosis (3).
La membrana interna difiere en su organización molecular de la membrana externa. Posee 80% de proteinas y 20% de lipidos. Se caracteriza por formar cierto numero de repliegues que se denominan crestas y que incrementan el area total de la superficie interna. Estas crestas aparecen como estructuras lamelares o tubulares, cuyo número está relacionado con las demandas energeticas de la celula (4). Esta membrana es impermeable a muchos solutos; todo paso a traves de ella se realiza gracias a proteinas transportadoras, que en su mayoria son hidrofobicas.
Tiene un bajo contenido de colesterol y un alto contenido de cardiolipina (difosfatidil glicerol), lo que permite que los lipidos citosolicos entren a la matriz para llevar a cabo la â-oxidacion. Estas características la hacen poco permeable a ciertos iones, excepto al ATP, ADP, ácido pirúvico, oxígeno y agua. Contiene tres tipos de proteinas: 1. Las que llevan a cabo las reacciones de oxidacion de la cadena respiratoria, 2. Un complejo enzimatico llamado ATPasa, que sintetiza el ATP en la matriz y 3. Proteinas transportadoras específicas que regulan el paso de metabolitos dentro y fuera de la matriz (5).
Entre las dos membranas queda delimitado un espacio intermembranal, compuesto de un líquido similar al hialoplasma, que contiene todas las moleculas que las porinas de la membrana externa dejan pasar (6). Este espacio es rico en protones, los cuales proceden del funcionamiento de los complejos de la cadena respiratoria y desempenan un papel esencial en la fosforilacion de ADP (4). El espacio intermembranal contiene también componentes claves implicados en la muerte celular de tipo apoptotico, como algunas caspasas, el factor inhibidor de la apoptosis (AIF) y el citocromo c, que se localiza sobre la cara interna de la membrana interna (8).
En microscopia electrónica la matriz mitocondrial se observa ligeramente densa y finamente granulosa, debido a los gránulos densos e irregulares de 50nm de diámetro propios de las acumulaciones de iones de Ca++ y Mg++ (7). Alberga moléculas de ADN y ARN mitocondrial, contiene iones, metabolitos a oxidar y ribosomas tipo 70S similares a los de las bacterias, llamados mitoribosomas, que realizan la síntesis de algunas proteínas mitocondriales (6.9). En la matriz mitocondrial tienen lugar diversas rutas metabólicas, por ejemplo las enzimas responsables de la oxidación del ácido pirúvico en el ciclo de Krebs y en la beta-oxidación de los ácidos grasos (5).
Aspectos funcionales
Eugene Kennedy y Albert Lehninger descubren en 1948 que la mitocondria en los eucariotas es el lugar donde se realiza la fosforilacion oxidativa, lo que marca el inicio de la fase moderna de los estudios sobre las transducciones de energia biologica (5). En las mitocondrias se desarrollan distintas reacciones bioquimicas catabolicas que liberan importantes cantidades de energia, la cual se almacena en forma de ATP y es usada para mantener la actividad celular (6). En los organismos aerobicos mas del 90% del ATP proviene de las mitocondrias, el resto se forma en la glicolisis anaerobica. El ATP es una molecula relativamente simple, formada por una ribosa, una adenina y tres fosfatos. La union entre los fosfatos se conoce como unión pirofosfato. Cuando el ATP se hidroliza a ADP y fosfato, se liberan aproximadamente 7.500 calorias por mol (4).
La fosforilacion oxidativa es la culminacion del metabolismo productor de energia en los organismos aerobicos. Todos los pasos oxidativos en la degradación de glucidos, grasas y aminoacidos convergen en esta etapa de la respiracion celular en la que la energia de oxidación impulsa la sintesis de ATP. La oxidacion de la glucosa se produce en dos etapas. La primera se conoce como glicolisis y la segunda es la respiracion que está compuesta de dos partes: el ciclo de Krebs y el transporte terminal de electrones. La glicolisis se produce en el citosol y las dos etapas de la respiracion en la mitocondria (5).
La glicolisis es un proceso que tiene como objeto la oxidacion de la glucosa para producir acido piruvico y formar una pequena cantidad de ATP a partir de ADP y fosfato. Durante este proceso son transferidos a las coenzimas aceptoras pocos electrones y sus protones acompanantes. El sistema dedicado al transporte de los electrones esta compuesto por cuatro complejos enzimaticos fijos y dos transportadores de electrones moviles: el complejo I o NADH deshidrogenasa que contiene flavina mononucleótido (FMN), el complejo II o succinato deshidrogenasa; ambos ceden electrones al coenzima Q o ubiquinona; el complejo III o citocromo bc1 cede electrones al citocromo c y el complejo IV o citocromo c oxidasa cede electrones al oxígeno para producir dos moléculas de agua, Figura 1 (4).
Proteinas transportadoras especificas en la membrana interna importan piruvato, ADP y pirofosfato hacia la matriz mitocondrial, y exportan el ATP. El NADH, generado en el citosol, no es transportado directamente a la matriz debido a la impermeabilidad de la membrana.Un sistema de lanzaderas transporta los electrones desde el NADH citosolico hacia el NAD+ de la matriz.
El oxígeno se difunde hacia la matriz y el CO2 lo hace hacia fuera. Los acidos grasos se unen a la coenzima A (CoA) en la membrana mitocondrial externa, luego el grupo acilo se separa de la CoA y se liga a la carnitina para ser transportado a traves de la membrana interna. El acido graso se vuelve a unir a un CoA en el lado matricial de la membrana interna. La oxidacion del piruvato en el ciclo del acido citrico genera NADH y FADH2. De estas coenzimas reducidas se transfieren los electrones al oxigeno a traves de los cuatro complejos transportadores de electrones y al mismo tiempo se transportan iones de hidrogeno desde la matriz al espacio intermembranal, con la cual se genera la fuerza proton motriz. Luego el complejo F0F1 dirige la fuerza proton motriz para sintetizar el ATP (4).
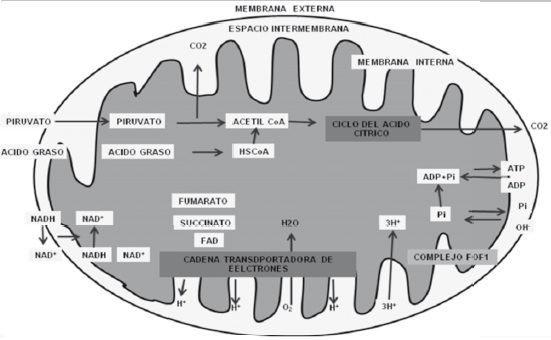
Figura 1. Oxidación aeróbica del piruvato en la mitocondria. 1. Transporte de los metabolitos hacia el interior de la membrana. Piruvato deshidrogenasa, ciclo del ácido cítrico y metabolismo de los ácidos grasos. 2. Transporte de electrones desde el NADH y el FADH2 hacia el oxígeno, generación de fuerza protón motriz. 3 Síntesis de ATP por el Fo-F1 mediante el empleo de la fuerza protón-motriz. Tomada y Modificada de H. Lodish (4).
El Potencial de membrana mitocondrial.
La energia que se obtiene a traves de la transferencia de electrones a lo largo de la cadena transportadora es usada para bombear protones desde la matriz mitocondrial hacia el espacio intermembranal, creando un gradiente electroquimico de protones a traves de la membrana mitocondrial interna (ΔØm: potencial de membrana mitocondrial). Este gradiente de protones permite a la ATP sintasa utilizar el flujo de H+ generados para producir ATP a partir de adenosina difosfato (ADP) y fosfato inorgánico. De esta manera, la membrana mitocondrial interna separa dos compartimientos de diferente concentracion de H+, lo que produce diferencias en la concentracion química (ΔpH) y en la distribucion de la carga (ΔØm) a través de la membrana. El resultado neto es la fuerza proton motriz (ΔG) (4).
La regulacion del potencial de la membrana interna de la mitocondria esta dada, en parte, por la via PI3K/Akt. Se ha demostrado que la activacion de Akt, promueve la supervivencia celular neuronal por la activacion de factores de crecimiento que actuan contra varios estimulos apoptoticos a traves de la modulacion de la actividad de la proteina Bcl-2 en las neuronas y de Bcl-xL en celulas de Schwann, ya que regulan la actividad del poro de permeabilidad transicional de la mitocondria e impiden la liberacion de proteinas apoptoticas (10,11). Ademas, los blancos de senalizacion de PI3K favorecen la transcripción de genes como CREB y el factor nuclear êB (NF-êB), que codifican para proteinas antiapoptoticas (12).
Muerte celular y mitocondria
Aunque no son claros los mecanismos que controlan la muerte celular, estudios detallados sobre la morfología de las celulas que mueren durante el desarrollo, han permitido identificar varias formas de muerte celular, entre ellas: autofagia, muerte celular no lisosomal, catástrofes mitoticas, paraptosis, necrosis y apoptosis o muerte celular programada; de las cuales, las dos ultimas han sido las mas estudiadas (8). La apoptosis es el mecanismo de muerte celular que se ha relacionado con mayor frecuencia a las enfermedades neurodegenerativas del sistema nervioso central. Por tal razon, se profundizara en sus mecanismo y su relacion con las alteraciones mitocondriales.
Apoptosis
La apoptosis es un mecanismo regulador esencial que interviene en la homeostasis tisular y en el desarrollo normal, eliminando las celulas innecesarias. El termino apoptosis (del griego: caida) fue usado originalmente por los botanicos, pero a principios de la decada de 1970, los cientificos escoceses Kerr, Wyllie y Currie lo reacunaron para describir la muerte de celulas del higado, que después de encogerse –y marchitarse– se desprendian de este organo como hojas en el otono (6).
El nematodo microscopico Caenorhabditis elegans ha sido utilizado como modelo experimental de apoptosis, ya que durante su desarrollo, 131 de 1090 celulas embrionarias mueren por este proceso y ademas se conoce la localizacion y transformacion precisa de todas sus celulas individuales (13). En este modelo se han identificado algunos genes necesarios para promover o impedir la muerte celular, denominados genes ced (Caenorhabditis elegan death). La presencia del gen ced-9 protege de la muerte celular, mientras que ced-3 y ced-4, la favorecen. En estudios posteriores, diversos investigadores han encontrado homologos en los mamiferos: la familia de proteinas Bcl-2 y la familia de las caspasas respectivamente (14,15).
Apoptosis vs. necrosis
La apoptosis y la necrosis se diferencian claramente: los agentes desencadenantes de la necrosis son de carácter toxico, traumatico o hipoxico, siempre patologicos. Ademas, se observan numerosas celulas vecinas comprometidas en este proceso. Hay destruccion de la membrana celular lo que permite el escape al exterior de elementos toxicos que provocan un proceso inflamatorio con efecto nocivo en el organismo. Segun la extension del proceso, el material cromatinico muestra un patron de dispersion irregular y la desintegracion celular no implica gasto de ATP.
En el proceso apoptotico se afectan determinadas celulas, sin que necesariamente sean contiguas, ni que se vea comprometida toda la poblacion de celulas que conforman un area tisular. La membrana celular no se destruye, lo que impide el escape de su contenido al espacio extracelular, favoreciendo un proceso “silencioso”, sin inflamacion. En el citoplasma se produce granulación fina, con conservacion de algunos organelos, en especial las mitocondrias. A nivel nuclear la cromatina se condensa en varios sectores formando los llamados cuerpos apoptoticos, lo que requiere gasto de ATP. La membrana celular se recoge sobre las elevaciones globuliformes que forman los elementos deteriorados del citoplasma y el nucleo. Finalmente los cuerpos apoptoticos externalizan algunos fosfolipidos de membrana, como la fosfatidilserina y algunas moleculas de adhesion, que los fagocitos reconocen, lo que impide que se produzca una reacción inflamatoria en el resto del tejido (16).
Las caspasas: enzimas fundamentales para la ejecución de la muerte
La mayoria de estimulos que conducen a la apoptosis convergen en la mitocondria y provocan una permeabilización de su membrana externa. Con la permeabilizacion se liberan una serie de proteinas que activan las caspasas (1,2,16). Estas inducen la mayoria de los acontecimientos proteoliticos de la apoptosis y son consideradas como responsables finales de la muerte celular. En el citoplasma y en el espacio intermembranal de las mitocondrias se localizan en forma de procaspasas, las cuales son activadas por clivaje y actúan como ejecutoras que escinden moleculas de supervivencia celular y ponen en marcha las actividades que inducen la muerte de la celula (17).
Actualmente se han identificado 14 caspasas en mamiferos; todas ellas presentan una secuencia conservada de 5 aminoacidos (QACR(N/Q) G) en el sitio activo. Las caspasa 1 y 11 funcionan principalmente en el procesamiento de citocinas, mientras que las caspasas 2, 3, 6, 7, 8, 9, 10 y 12 participan en la regulacion y ejecucion de la apoptosis (17,2). Las caspasas son divididas en dos grupos: caspasas iniciadoras con un predominio largo (2,9,10,16) y caspasas efectoras con un prodomino corto (3,6,7) que actuan sobre las endonucleasas y son las responsables directas de la fragmentacion del ADN (18,19). La cadena de degradacion proteica tiene sucesivos clivajes dependientes de la ubicacion del ácido aspartico que se repite en la estructura de la enzima. La funcion de las otras caspasas esta por describirse (20). Actualmente hay dos vias alternativas para activar las caspasas. Una es iniciada por senales externas que activan un receptor de muerte en la superficie celular (via extrinseca). La otra es disparada por cambios en la integridad mitocondrial (via intrinseca) (21,22).
Vía extrínseca
Las celulas de los mamiferos expresan receptores localizados en su membrana plasmatica. La union de ligandos a estos receptores desencadena la activacion de las caspasas y una cascada de reacciones que finalizan con la muerte celular. Algunos de estos receptores son el Fas, el receptor-1 del factor de necrosis tumoral (TNF-R1) y el DR3 (23). La fijacion del Fas ligando a su receptor (Fas) provoca el reclutamiento citoplasmatico del adaptador FADD (del ingles Fas-associated death domain protein), al cual fija la procaspasa 8. Este complejo se realiza por interacciones homofilicas entre secuencias polipeptidicas designadas como dominios efectores de muerte (DED, del ingles death effector domain), que estan presentes en ambas proteinas. La asociacion Fas/FADD y procaspasa 8 forma un complejo denominado Complejo de señalización de muerte (DISC, por sus iniciales en ingles Death Inducing Signalling Complex). La procaspasa 8 es activada en el DISC por una proteolisis y actua sobre las procaspasas 3, 6 y 7 que coordinan, entonces, la muerte celular. Algo similar sucede con el receptor TNF-R1 (22, 23).
Vía intrínseca: la mitocondria como mediador en el proceso de apoptosis.
Durante décadas se consideró a la mitocondria como un organelo encargado exclusivamente de oxidar sustratos, produciendo agua en un proceso acoplado a la fosforilacion en la produccion de ATP. En la actualidad se sabe que en la mitocondria existe un proceso latente de transporte, conocido como “permeabilidad transicional mitocondrial”, cuya activacion se presenta bajo ciertas condiciones y se traduce en la permeabilizacion de la membrana mitocondrial a iones que incluyen el calcio (24). Se ha propuesto que esta permeabilidad mitocondrial, podria ser una de las vias de conducción de moleculas pro-apoptoticas.
Hoy en dia, se sabe que el poro se abre cuando hay un exceso de calcio y fosfato, lo que despolariza la mitocondria y desacopla la cadena respiratoria. El poro de permeabilidad transicional mitocondrial (PTPm), favorece la cascada de caspasas y favorece la muerte celular al liberar factores inductores de apoptosis como el citocromo c, factores de fragmentacion del nucleo y proteinas como SMAC/ DIABLO que neutralizan los inhibidores endogenos de la apoptosis (AIF, por sus iniciales en inglés Apoptosis Inducing Factor), Figura 2 (25,26).
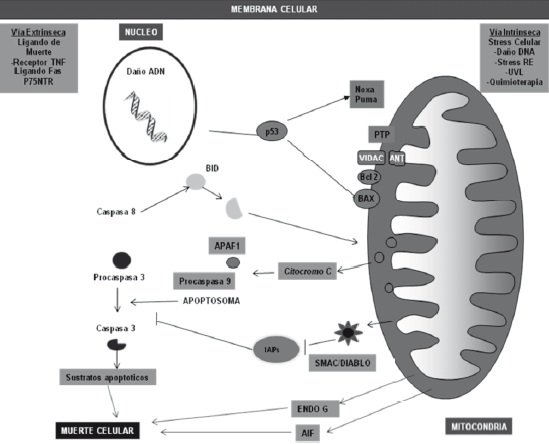
Figura 2. Mitocondria como mediador en el proceso de apoptosis. Estímulos apotóticos activan proteínas efectoras que se translocan desde el citosol a la mitocondria y originan la liberación de proteínas apoptoticas a través de un mecanismo desconocido que involucra miembros de la familia Bcl2 y el poro de permeabilidad transicional que ocasiona la liberación de proteína inhibidoras y activadores de la apoptosis. Factor inductor de la apotosis (AIF), promotor de fragmentación nuclear EndoG, proteína inhibidora de apoptosis (IAP). Tomado y modificado de Parone PA (26).
La proteina de translocacion mitocondrial (TSPO) de 18 KDa, interactua con VDAC para desempenar un papel en la apoptosis. En este contexto, TSPO parece participar en la generacion de especies reactivas de oxigeno (ROS). Esta generacion de ROS induce la activacion de la via mitocondrial de la apoptosis. ROS son conocidos por ser capaces de liberacion de citocromo c. (27,28). Evidencias recientes indican que la caspasa 2 puede estar directamente involucrada en la liberacion de citocromo c desde la mitocondria en las celulas apoptoticas (27). Esta caspasa es la más conservada entre las especies y fue la primera clonada en humanos. Se activa tempranamente en respuesta a stress genotoxico y puede funcionar como modulador del camino apoptotico mitocondrial. Recientes estudios han demostrado que la activacion de la caspasa 2 ocurre dentro de un complejo multiproteico, con proteinas inducidas por el gen supresor tumoral p53, PIDD (del ingels p53-induced protein with death domain), las proteinas adaptadoras de muerte RAIDD y otras proteinas (30).
La permeabilizacion de la membrana externa y consiguiente liberacion de citocromo c es considerada un paso clave y de no retorno en el inicio del proceso apoptotico. Una vez en el citoplasma, el citocromo c, junto a la molecula adaptadora Apaf-1 participa en la formacion del complejo del apoptosoma, lo que resulta en el reclutamiento y procesamiento de la procaspasa 9 hacia su forma activa (caspasa 9), en presencia de ATP.
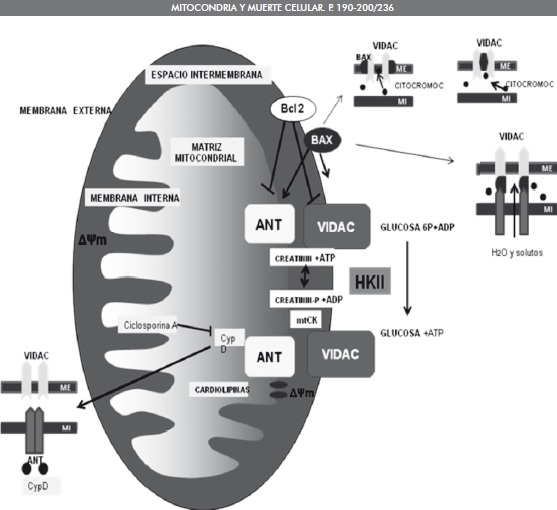
Figura 3. Estructura hipotética del poro de permeabilidad transicional mitocondrial. Canales aniónicos dependientes de voltaje (VDAC), Translocador de nucleotidos de andenina (ANT), Receptor periférico de benzodiacepinas (PBR), creatinina kinasa mitocondrial (mtCK), Ciclofilina D peptidil prolilisomerasa (Cyp D), familia Bcl-2. Tomado y modificado de Zamzani (32).
Subsecuentemente la caspasa 9 cliva y activa la procaspasa 3 y 7 (caspasas efectoras) que son las responsables del clivaje de varias proteinas que llevan a las características bioquimicas y morfologicas de la apoptosis (31,2).
El poro de permeabilidad transicional mitocondrial (PtPm)
El PTPm se ubica en los sitios de union entre las membranas interna y externa de la mitocondria. Es un complejo multiproteico capaz de formar poros no selectivos en la membrana interna. Los componentes estructurales del poro son: 1. El translocador de nucleotidos de adenin (ANT), ubicado en la membrana interna; 2. La ciclofilina D, ubicada en la matriz y 3. El VDAC o porina, localizada en la membrana externa. Adicionalmente, se han encontrado receptores de benzodiacepinas unidos al poro en la membrana externa, creatin quinasas en el espacio intermembranal y hexoquinasas II ligadas al VDAC en la fase citosolica de la membrana externa, asi como proteinas Bax/Bcl-2, Figura 3 (32).
El VDAC es normalmente permeable a solutos de 1.5 kDa, lo que permite el libre intercambio de sustratos de la cadena respiratoria tales como el NADH y el FADH, el ATP/ADP entre el espacio intermebranal y el citosol. En contraste, la membrana interna es casi impermeable lo que permite generar el gradiente electroquímico de protones usado en la fosforilacion oxidativa. Sin embargo, la permeabilidad de ambas membranas puede ser interrumpida, como se ha demostrado in vitro (32). De esta forma, la apertura del canal en la membrana interna disipa el gradiente de H+ a traves de la membrana, desacoplando la cadena respiratoria de la produccion de ATP. Como resultado se hincha la matriz, lo que provoca la ruptura de la membrana externa permitiendo la salida de las moleculas proapoptoticas, Figura 3 (33).
Aunque se ha escrito mucho sobre el papel regulador que podrian tener otras proteinas y sobre los factores que inducen la probabilidad de que el poro se abra, es de resaltar que los inductores fisiologicos son importantes en su funcion. Se conoce que el poro se cierra cuando existe una baja carga energetica, probablemente para optimizar la fosforilacion oxidativa, mientras que en presencia de una alta carga energetica se abre, posiblemente con el fin de liberar, en forma de calor, la energia producida por la cadena respiratoria. Es asi como la entrada de calcio al citoplasma puede cerrar el poro, lo que obliga a la mitocondria a producir el ATP que necesita la celula para su funcionamiento. Si se comprende la permeabilidad del poro, es posible que se pueda llegar a controlar la muerte celular accidental en procesos como la isquemia, enfermedades neurodegenerativas, entre otras.
La familia Bcl-2 y su interacción con el mPTP
La familia de proteinas Bcl-2 (homologo del protooncogen responsable del linfoma folicular humano) es determinante en el control de la vida y la muerte de la celula. Estas proteinas se sintetizan justamente en la membrana de la mitocondria y juegan un rol pro o antiapoptotico, ya que pueden aumentar la permeabilidad de la membrana o disminuirla hasta bloquear el escape de citocromo c y de AIF (34). Las proteinas sintetizadas en esta familia son: Bcl-2, Bcl-xL, Bcl W y BRAG, que inhiben la apoptosis. Mediante fosforilacion se originan proteinas con accion proapoptotica como Bax, Bak, Bad, y Bcl x 5, pues producen una caida del potencial transmembranal con el consecuente aumento en la permeabilidad membranal. Ademas, actuan como activadores de las vías proapoptoticas Fas y TNF y de algunas caspasas (35).
Un segundo mecanismo, a traves del cual el citocromo c puede ser liberado al citosol, es a traves de un canal que se forma en la membrana externa mitocondrial, cuando proteinas de la familia de Bcl-2 como Bax y Bak, que se encuentra normalmente en el citosol, se translocan a la mitocondria y se oligomerizan para formar una estructura de poro durante la apoptosis. Estas proteinas forman un canal que permite la salida de citocromo c (36).
Ademas del efecto directo que se cree tienen las proteinas de la familia Bcl-2 sobre la permeabilidad mitocondrial, tambien se ha reportado que Bax podria tener una funcion independiente estimulando la salida de calcio del reticulo endoplasmico y dirigiendolo hacia la mitocondria. El mecanismo que favorece este movimiento no se ha determinado, pero se ha sugerido que podria involucrar los sitios de contacto entre estos dos organelos (37). Otros autores proponen que el calcio mitocondrial puede promover la incorporación de Bax a la membrana externa (38-40), aunque también se ha reportado la liberacion de citocromo c inducida por Bax independiente de calcio (41).
La subfamilia BH3 parece ser guardiana del daño celular y critica para desencadenar la apoptosis. Son proteinas inductoras de muerte que subyacen a varios mecanismos de control (42,43). Algunas proteinas se regulan a nivel transcripcional, como es el caso de noxahrk(44), cuya expresion se induce en respuesta a estimulos proapoptoticos. Otras lo hacen a traves de modificaciones postransduccionales como Bid (45), que se mantiene inactivo hasta que es cortadas por una caspasa, lo que genera el fragmento tBid, o Bim, que es secuestrado por los microtubulos al interactuar con la dineina LC8 (46).
Bad es un ejemplo de la regulacion de la actividad por fosforilacion (47,48), cuando esta desfosforilada se asocia a Bcl-XL en la mitocondria y promueve la muerte, en cambio, al ser fosforilada se encuentra en el citoplasma asociada a la proteina chaperona 14-3-3, que se unen a proteinas fosforiladas en serinas y pierde la capacidad de interactuar con Bcl-XL. La cinasa Akt es la responsable de la activacion e inactivacion de Bad (49,50).
Proyecciones
Es ahora claro que la mitocondria juega un papel crítico en la muerte celular en la regulacion tanto de la apoptosis como de la necrosis. La permeabilizacion de la membrana mitocondrial y liberacion de proteinas al espacio intermembranal son caracteristicas importantes de estos dos mecanismos. La apoptosis es un proceso complejo que merece ser estudiado no solo por su relevancia en el funcionamiento normal de los organismos, sino porque su desregulacion favorece el surgimiento de enfermedades como el cancer o las que involucran degeneracion celular como en las enfermedades neurogenerativas. Entender los mecanismos moleculares implicados en la regulación de la muerte celular y su relacion con las vias de señalización, incrementa el conocimiento y comprensión sobre la formacion y funcionamiento de los organismos y permite el diseno y la creacion de nuevos potenciales terapeuticos.
Agradecimientos
Financiado por la DIB - Universidad Nacional de 110145221189. Colombia, codigo No. 8009100 y Colciencias codigo No.
Referencias
1. Hengartner MO. The biochemistry of apoptosis. Nature. 2000;12;407:770-776.
2. Amarante-Mendes GP, Green DR.The regulation of apoptotic cell death. Braz J Med Biol Res. 1999;32:1053-1061.
3. Alberts B,. Johnson A, Lewis J, Raff M, Roberts K, Walter P. Molecular biology of the cell. Omega Eds, España. 2002. pg. 767-769.
4. Lodish H. Biología celular y molecular. Médica Panamericana Eds., Madrid, 2006. pg. 513-634
5. Lehninger D, Michael N, Cox M. Principles of Biochemistry. Fourth Edition.2002. pg. 659-670
6. Ge ydan, Gil , Giraldo, Gonzá le z , Jaramillo, Maestre, McEwen, Muñetón, Ossa, Parra, Patiño, Ramírez, Rodríguez, Rojas Rugeles, Segura, Spinel, Yildiz, Vásquez. Biología de la célula. 1ª Ed. Colombia: Fondo Editorial Biogénesis. Mayo de 2006.
7. Grimm S, Brdiczka D. The permeability transition pore in cell death. Apoptosis. 2007;12:841-855.
8. Leist M, Jäättelä M. Four deaths and a funeral: from caspases to alternative mechanisms. Nat Rev Mol Cell Biol. 2001;2:589-598.
9. De Souza-Pinto NC, Wilson DM 3rd, Stevnsner TV, Bohr VA. Mitochondrial DNA, base excision repair and neurodegeneration. DNA Repair (Amst). 2008;1:1098-1109.
10. Arboleda G, Huang TJ, Waters C, Verkhratsky A, Fernyhough P, Gibson RM. Insulin-like growth factor 1-dependent maintenance of neuronal metabolism through the phosphatidylinositol 3-kinase- Akt pathway is inhibited by C2-ceramide in CAD cells. Eur JNeurosci. 2007;25:3030-3038.
11. Vander Heiden MG, Li XX, Gottleib E, Hill RB, Thompson CB, Colombini M. Bcl-xL promotes the open configuration of the voltagedependent anion channel and metabolite passage through the outer mitochondrial membrane. J Biol Chem. 2001;276:19414-19419.
12. Park JM, Greten FR, Wong A, Westrick RJ, Arthur JS, Otsu K, Hoffmann A, Montminy M, Karin M. Signaling pathways and genes that inhibit pathogen-induced macrophage apoptosis--CREB and NF-kappaB as key regulators. Immunity. 2005;23:319-329.
13. Zou H, Henzel WJ, Liu X, Lutschg A, Wang X. Apaf-1, a human protein homologous to C. elegans CED-4, participates in cytochrome c-dependent activation of caspase-3. Cell. 1997;90:405-413.
14. Adams JM, Cory S. Life-or-death decisions by the Bcl-2 protein family. Trends Biochem Sci. 2001;26:61-66.
15. Suen DF, Norris KL, Youle RJ. Mitochondrial dynamics and apoptosis. Genes Dev. 2008;22:1577 1590.
16. Susin SA, Lorenzo HK, Zamzami N, Marzo I, Snow BE, Brothers GM, et al. Molecular characterization of mitochondrial apoptosisinducing factor. Nature. 1999;397:441-446.
17. Green D, Kroemer G. The central executioners of apoptosis: caspases or mitochondria? Trends Cell Biol. 1998;8:267-271.
18. Li LY, Luo X, Wang X. Endonuclease G is an apoptotic DNase when released from mitochondria. Nature. 2001;412:95-99.
19. Zamzami N, Susin SA, Marchetti P, Hirsch T, Gómez-Monterrey I, Castedo M, Kroemer G. Mitochondrial control of nuclear apoptosis. J Exp Med. 1996;183:1533-1544.
20. Susin SA, Daugas E, Ravagnan L, Samejima K, Zamzami N, Loeffler M, et al. Two distinct pathways leading to nuclear apoptosis. J Exp Med. 2000;192:571-580.
21. Hengartner MO. The biochemistry of apoptosis. Nature. 2000;407:770-776.
22. Thorburn A. Death receptor-induced cell killing. Cell Signal. 2004;16:139-144.
23. Liu X, Kim CN, Yang J, Jemmerson R, Wang X. Induction of apoptotic program in cell-free extracts: requirement for dATP and cytochrome c. Cell. 1996;86:147-157.
24. Verhagen AM, Ekert PG, Pakusch M, Silke J, Connolly LM, Reid GE, Moritz RL, Simpson RJ, Vaux DL Identification of DIABLO, a mammalian protein that promotes apoptosis by binding to and antagonizing IAP proteins. Cell. 2000;102:43-53.
25. Du C, Fang M, Li Y, Li L, Wang X. Smac, a mitochondrial protein that promotes cytochrome c dependent caspase activation by eliminating IAP inhibition. Cell. 2000;102:33-42.
26. Parone PA, James D, Martinou JC. Mitochondria: regulating the inevitable. Biochimie. 2002;84:105-111.
27. Orrenius S, Gogvadze V, Zhivotovsky B. Mitochondrial oxidative stress:implications for cell death. Annu Rev Pharmacol Toxicol. 2007; 47:143-83.
28. Veenman L, Shandalov Y, Gavish M. VDAC activation by the 18 kDa translocator protein (TSPO), implications for apoptosis. J Bioenerg Biomembr. 2008;40:199-205.
29. Susin SA, Lorenzo HK, Zamzami N, Marzo I, Brenner C, Larochette N, et al. Mitochondrial release of caspase-2 and -9 during the apoptotic process. J Exp Med. 1999;189:381-394.
30. Tinel A, Tschopp J. The PIDDosome, a protein complex implicated in activation of caspase-2 in response to genotoxic stress. Science. 2004; 304:843-846.
31. Gogvadze V, Orrenius S. Mitochondrial regulation of apoptotic cell death. Chem Biol Interact. 2006;163:4-14.
32. Zamzami N, Kroemer G. The mitochondrion in apoptosis: how Pandora’s Box opens. Nat Rev Mol Cell Biol. 2001;2:67-71.
33. Shoshan-Barmatz V, Keinan N, Zaid H. Uncovering the role of VDAC in the regulation of cell life and death. J Bioenerg Biomembr. 2008;40:183-191.
34. Shimizu S, Narita M, Tsujimoto Y. Bcl-2 family proteins regulate the release of apoptogenic cytochrome c by the mitochondrial channel VDAC. Nature. 1999;399:483-487.
35. Shimizu S, Eguchi Y, Kamiike W, Funahashi Y, Mignon A, Lacronique V, Matsuda H, Tsujimoto Y. Bcl-2 prevents apoptotic mitochondrial dysfunction by regulating proton flux. Proc Natl Acad Sci USA. 1998;95:1455-1459.
36. Zha J, Harada H, Yang E, Jockel J, Korsmeyer SJ. Serine phosphorylation of death agonist BAD in response to survival factor results in binding to 14-3-3 not BCL-X(L) Cell. 199615;87:619-628.
37. Luo X, Budihardjo I, Zou H, Slaughter C, Wang X. Bid, a Bcl2 interacting protein, mediates cytochrome c release from mitochondria in response to activation of cell surface death receptors. Cell. 1998;94:481-490.
38. Murphy KM, Streips UN, Lock RB. Bcl-2 inhibits a Fas-induced conformational change in the Bax N terminus and Bax mitochon drial translocation.J Biol Chem. 2000;275:17225-17228.
39. Narita M, Shimizu S, Ito T, Chittenden T, Lutz RJ, Matsuda H, Tsujimoto Y. Bax interacts with the permeability transition pore to induce permeability transition and cytochrome c release in isolated mitochondria. Proc Natl Acad Sci USA. 19988;95:14681-14686.
40. Marzo I, Brenner C, Zamzami N, Jürgensmeier JM, Susin SA, Vieira HL, Prévost MC, Xie Z, Matsuyama S, Reed JC, Kroemer G. Bax and adenine nucleotide translocator cooperate in the mitochondrial control of apoptosis. Science. 1998;281:2027-2031.
41. Rizzuto R, Brini M, Murgia M, Pozzan T. Microdomains with high Ca2+ close to IP3-sensitive channels that are sensed by neighboring mitochondria. Science. 1993;262:744-747.
42. Huang DC, Strasser A. BH3-Only proteins-essential initiators of apoptotic cell death. Cell. 2000;103:839-842.
43. Kelekar A, Thompson CB. Bcl-2-family proteins: the role of the BH3 domain in apoptosis. Trends Cell Biol. 1998;8:324-330.
44. Zhivotovsky B, Kroemer G. Apoptosis and genomic instability. Nat Rev Mol Cell Biol. 2004;5:752-762.
45. Desagher S, Osen-Sand A, Nichols A, Eskes R, Montessuit S, Lauper S, et al. Bid-induced conformational change of Bax is responsible for mitochondrial cytochrome c release during apoptosis. J Cell Biol. 1999;144:891-901.
46. Puthalakath H, Huang DC, O’Reilly LA, King SM, Strasser A. The proapoptotic activity of the Bcl-2 family member Bim is regulated by interaction with the dynein motor complex. Mol Cell. 1999;3:287-296.
47. Ayllón V, Fleischer A, Cayla X, García A, Rebollo A. Segregation of Bad from lipid rafts is implicated in the induction of apoptosis. J Immunol. 2002; 168:3387-3393.
48. Fleischer A, Ghadiri A, Dessauge F, Duhamel M, Cayla X, Garcia A, Rebollo A. Bad-dependent rafts alteration is a consequence of an early intracellular signal triggered by interleukin-4 deprivation. Mol Cancer Res. 2004;2:674-684.
49. del Peso L, González-García M, Page C, Herrera R, Nuñez G. Interleukin-3-induced phosphorylation of BAD through the protein kinase Akt. Science. 1997;278:687-689.
50. Shimamura H, Terada Y, Okado T, Tanaka H, Inoshita S, Sasaki S. The PI3-kinase-Akt pathway promotes mesangial cell survival and inhibits apoptosis in vitro via NF-kappa B and Bad. J Am Soc Nephrol. 2003; 14:1427-1434.



